 資源預覽
資源預覽


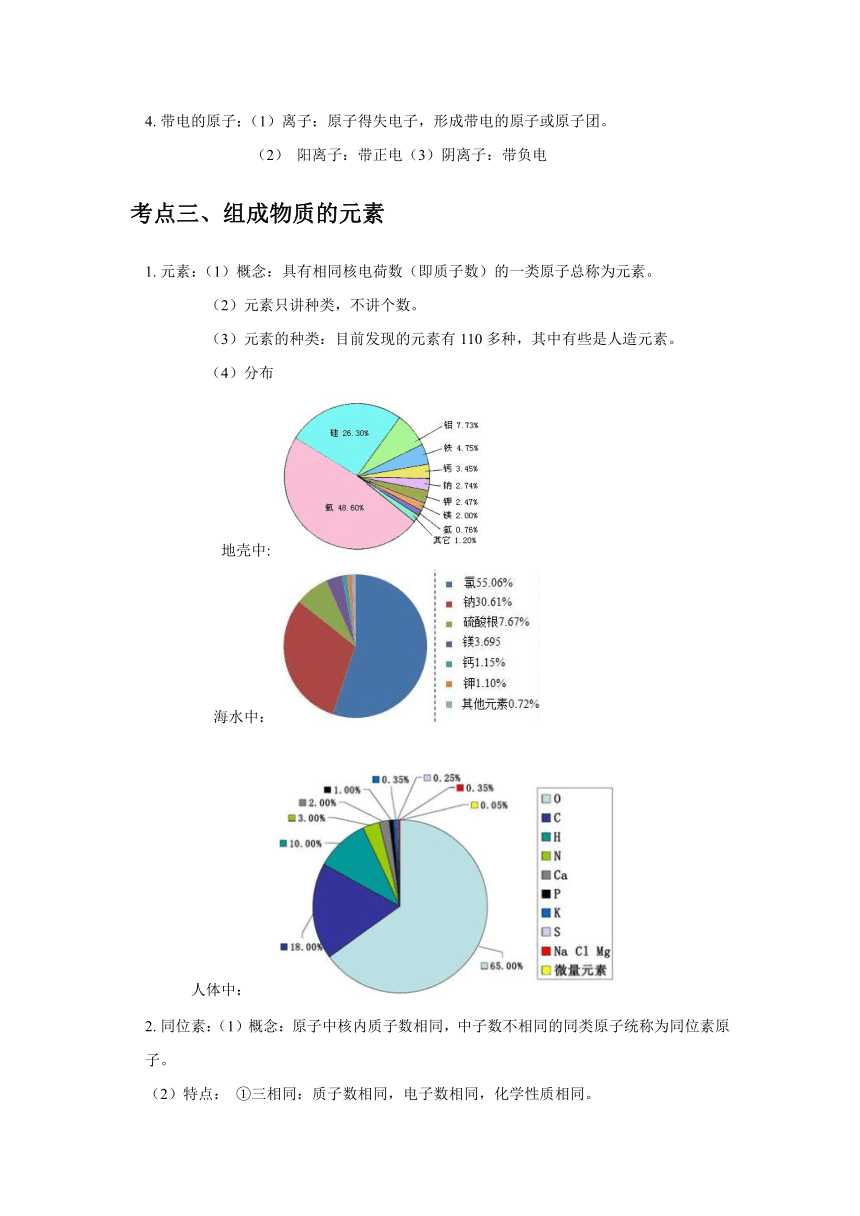
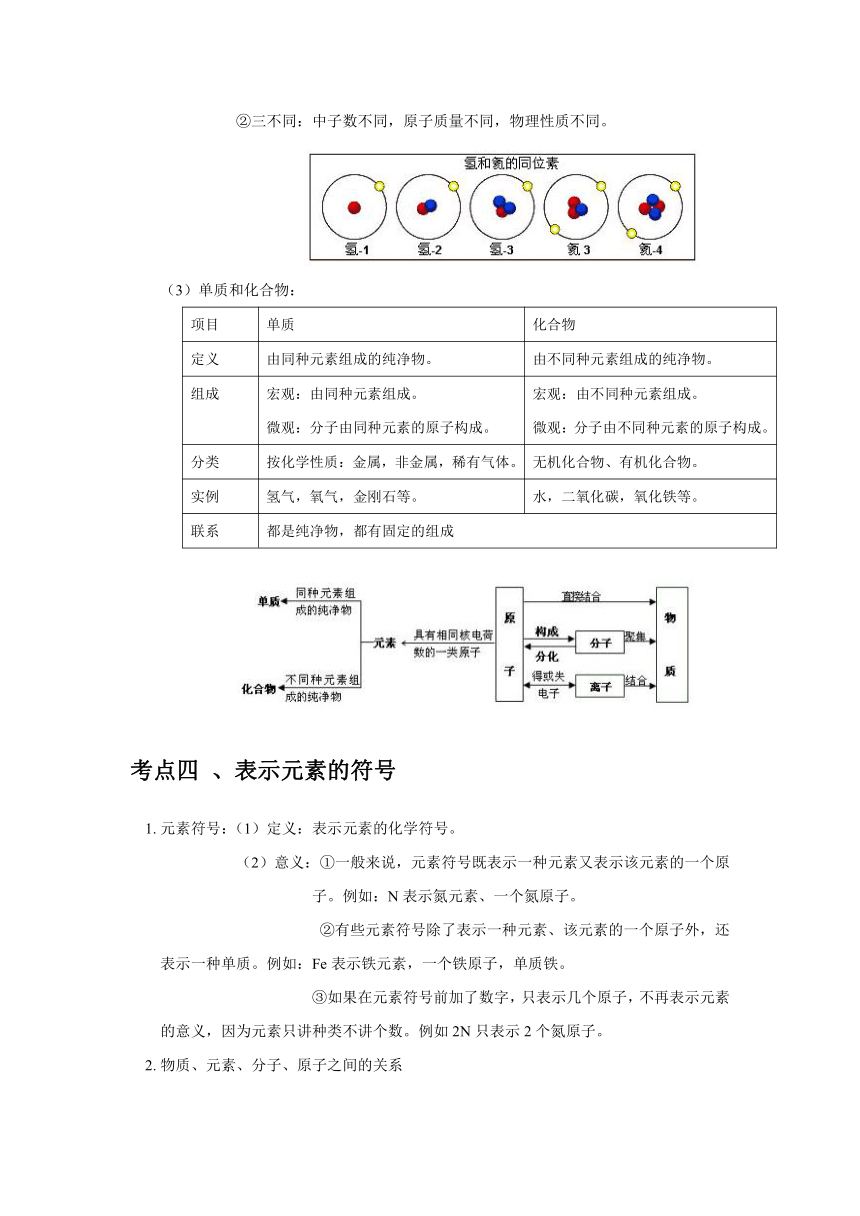
 資源預覽
資源預覽



