資源簡(jiǎn)介
資源簡(jiǎn)介
1.常見(jiàn)的制取氫氣的金屬 Mg、Al、Zn、Fe 。
分別與鹽酸反應(yīng)的化學(xué)方程式① Mg+2HCl=MgCl2+H2↑ ;
② 2Al+6HCl=2AlCl3+3H2↑ ;
③ Zn+2HCl=Z'nCl2+H2↑ ;
④ Fe+2HCl=FeCl2+H2↑ 。
2.制取H2常見(jiàn)的考點(diǎn)
①相同條件下,金屬M(fèi)g、Al、Zn、Fe與足量的稀鹽酸反應(yīng),產(chǎn)生H2的速度由快到慢的是 Mg>Al>Zn>Fe 。
②過(guò)量的金屬M(fèi)g、Al、Zn、Fe與等質(zhì)量等濃度的稀鹽酸反應(yīng)制取的H2的質(zhì)量比為 1:1:1:1 。
拓展:產(chǎn)生1gH2所需要的四種金屬的質(zhì)量分別是 Mg:12g;Al:9g;Zn:32.5g;Fe:28g 。
畫出圖像1:(X-時(shí)間,Y-H2的質(zhì)量)
③等質(zhì)量的金屬M(fèi)g、Al、Zn、Fe與足量的稀鹽酸反應(yīng)制取的H2,產(chǎn)生H2的量由多到少的是 Al>Mg>Fe>Zn 。
畫出圖像1:(X-時(shí)間,Y-H2的質(zhì)量) 圖像2:(X-HCl的質(zhì)量,Y- H2的質(zhì)量)
拓展:如何判斷金屬產(chǎn)生H2量的多少? 金屬的相對(duì)原子質(zhì)量/化合價(jià) 越小,等質(zhì)量時(shí)產(chǎn)生的H2的量越多。
④等質(zhì)量金屬與Mg、Al、Zn、Fe與足量的稀鹽酸反應(yīng)后,溶液質(zhì)量增加量由大到小的是 Zn<Fe<Mg<Al 。
⑤生成相同化合價(jià)的金屬(假設(shè)X、Y均為+2價(jià)),產(chǎn)生H2的量越小,相對(duì)分子量 越大 。
例1、等質(zhì)量、等濃度的稀硫酸分別與足量的鎂、鐵、鋅三種金屬反應(yīng),下列圖像能正確表示產(chǎn)生氫氣的質(zhì)量與反應(yīng)時(shí)間關(guān)系的是( )
A. B.
C. D.
例2、在學(xué)習(xí)了金屬的化學(xué)性質(zhì)后,科學(xué)老師布置了一項(xiàng)課外學(xué)習(xí)任務(wù):調(diào)查化工顏料店出售的涂料添加劑“銀粉”是什么金屬?某學(xué)習(xí)小組通過(guò)調(diào)查,分別獲得了“銀粉”是銀粉、鋁粉、鋅粉這三種不同結(jié)果。為了確定究竟是哪一種金屬,學(xué)習(xí)小組同學(xué)將一小包“銀粉”帶回實(shí)驗(yàn)室,進(jìn)行了如下實(shí)驗(yàn)和分析。(相關(guān)反應(yīng)的化學(xué)方程式為:Zn+H2SO4═ZnSO4+H2↑;2Al+3H2SO4═Al2(SO4)3+3H2↑)
(1)取少量“銀粉”于試管中,滴加適量鹽酸,觀察到有 產(chǎn)生,說(shuō)明“銀粉”一定不是銀。
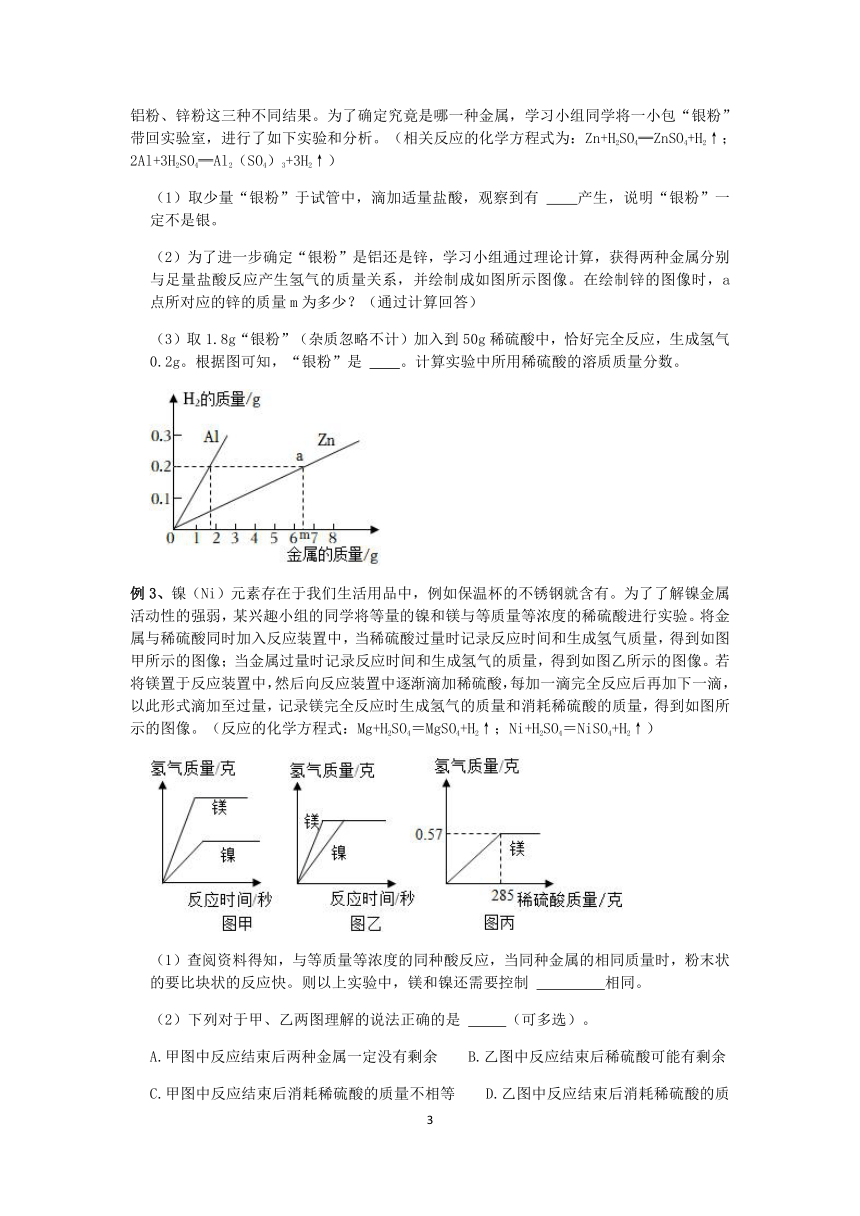
(2)為了進(jìn)一步確定“銀粉”是鋁還是鋅,學(xué)習(xí)小組通過(guò)理論計(jì)算,獲得兩種金屬分別與足量鹽酸反應(yīng)產(chǎn)生氫氣的質(zhì)量關(guān)系,并繪制成如圖所示圖像。在繪制鋅的圖像時(shí),a點(diǎn)所對(duì)應(yīng)的鋅的質(zhì)量m為多少?(通過(guò)計(jì)算回答)
(3)取1.8g“銀粉”(雜質(zhì)忽略不計(jì))加入到50g稀硫酸中,恰好完全反應(yīng),生成氫氣0.2g。根據(jù)圖可知,“銀粉”是 。計(jì)算實(shí)驗(yàn)中所用稀硫酸的溶質(zhì)質(zhì)量分?jǐn)?shù)。
例3、鎳(Ni)元素存在于我們生活用品中,例如保溫杯的不銹鋼就含有。為了了解鎳金屬活動(dòng)性的強(qiáng)弱,某興趣小組的同學(xué)將等量的鎳和鎂與等質(zhì)量等濃度的稀硫酸進(jìn)行實(shí)驗(yàn)。將金屬與稀硫酸同時(shí)加入反應(yīng)裝置中,當(dāng)稀硫酸過(guò)量時(shí)記錄反應(yīng)時(shí)間和生成氫氣質(zhì)量,得到如圖甲所示的圖像;當(dāng)金屬過(guò)量時(shí)記錄反應(yīng)時(shí)間和生成氫氣的質(zhì)量,得到如圖乙所示的圖像。若將鎂置于反應(yīng)裝置中,然后向反應(yīng)裝置中逐漸滴加稀硫酸,每加一滴完全反應(yīng)后再加下一滴,以此形式滴加至過(guò)量,記錄鎂完全反應(yīng)時(shí)生成氫氣的質(zhì)量和消耗稀硫酸的質(zhì)量,得到如圖所示的圖像。(反應(yīng)的化學(xué)方程式:Mg+H2SO4=MgSO4+H2↑;Ni+H2SO4=NiSO4+H2↑)
(1)查閱資料得知,與等質(zhì)量等濃度的同種酸反應(yīng),當(dāng)同種金屬的相同質(zhì)量時(shí),粉末狀的要比塊狀的反應(yīng)快。則以上實(shí)驗(yàn)中,鎂和鎳還需要控制 相同。
(2)下列對(duì)于甲、乙兩圖理解的說(shuō)法正確的是 (可多選)。
A.甲圖中反應(yīng)結(jié)束后兩種金屬一定沒(méi)有剩余 B.乙圖中反應(yīng)結(jié)束后稀硫酸可能有剩余
C.甲圖中反應(yīng)結(jié)束后消耗稀硫酸的質(zhì)量不相等 D.乙圖中反應(yīng)結(jié)束后消耗稀硫酸的質(zhì)量相等
(3)取與鎂等質(zhì)量的鎳置于反應(yīng)裝置中,然后采用與鎂相同的方式向反應(yīng)裝置中滴加稀硫酸。請(qǐng)?jiān)诒麍D上畫出鎳與稀硫酸反應(yīng)產(chǎn)生氫氣質(zhì)量與稀硫酸質(zhì)量的關(guān)系圖,標(biāo)出鎳完全反應(yīng)時(shí)生成氫氣質(zhì)量和消耗稀硫酸的質(zhì)量。
1.向一定量的鋅粉中逐滴加入稀鹽酸至過(guò)量,根據(jù)圖像判斷,y軸不可能表示( )
A.生成氫氣的質(zhì)量 B.溶液的總質(zhì)量
C.生成氯化鋅的質(zhì)量 D.消耗鋅粉的質(zhì)量
2.將質(zhì)量相等的鋅、鐵兩種金屬,同時(shí)分別放入質(zhì)量分?jǐn)?shù)相同且等質(zhì)量的稀鹽酸中,反應(yīng)生成的氫氣與反應(yīng)時(shí)間的關(guān)系如圖所示。根據(jù)圖中所提供的信息,得出的結(jié)論錯(cuò)誤的是( )
A.折線X表示鋅的反應(yīng)情況
B.鋅和鐵都已被完全反應(yīng)
C.生成氫氣的質(zhì)量相等
D.鹽酸都已被完全反應(yīng)
3.在定量研究金屬與酸的化學(xué)反應(yīng)時(shí),繪制出如圖所示金屬與氫氣質(zhì)量關(guān)系的圖象,分析圖像得到的以下結(jié)論中,正確的是( )
①Na、Mg、Zn三種金屬都能置換出酸中的氫
②生成相同質(zhì)量的氫氣消耗金屬的質(zhì)量為Na>Mg=Zn
③生成相同質(zhì)量的氫氣消耗Na、Mg、Zn三種金屬的質(zhì)量比為23:24:65
④生成相同質(zhì)量的氫氣消耗Na、Mg、Zn三種金屬的原子個(gè)數(shù)比為2:1:1
A.①③ B.②③ C.①④ D.③④
4.課外探究時(shí)小金選擇了“金屬的顆粒大小對(duì)其與鹽酸反應(yīng)快慢的影響”的課題。實(shí)驗(yàn)時(shí)取質(zhì)量相等的鋅粉和鋅片,分別加入足量稀鹽酸中,反應(yīng)生成氫氣的質(zhì)量(m)與反應(yīng)時(shí)間(t)的關(guān)系曲線如圖。圖中A表示鋅粉與鹽酸反應(yīng)的曲線圖,據(jù)圖分析:
(1)對(duì)鋅片而言,0~t2段的時(shí)間里表示其與鹽酸反應(yīng),氫氣質(zhì)量增加,鋅片的質(zhì)量 (選填“增加”或“減少”或“不變”);
(2)A、B曲線有部分重合,即m1所對(duì)應(yīng)的部分,m1表示 時(shí)產(chǎn)生的氫氣質(zhì)量;
(3)實(shí)驗(yàn)結(jié)論 ;
(4)請(qǐng)你再提出一個(gè)影響金屬與鹽酸反應(yīng)快慢的合理因素 。
5.已知鈉與水反應(yīng)的化學(xué)方程式為:2Na+2H2O═2NaOH+H2↑。質(zhì)量均為m g的鈉、鎂、鋅三種金屬分別與25g質(zhì)量分?jǐn)?shù)為19.6%的稀硫酸反應(yīng)。
(1)由于金屬的量不確定,產(chǎn)生的氫氣的質(zhì)量大小有多種可能(不考慮鎂與水的反應(yīng)),如鎂、鋅產(chǎn)生氫氣的質(zhì)量相同且都小于鈉產(chǎn)生的氫氣質(zhì)量的情況表示為Na>Mg=Zn。請(qǐng)按以上表示,寫出所有可能情況 。
(2)試確定,當(dāng)產(chǎn)生的氫氣的質(zhì)量大小為Na>Mg=Zn時(shí),m的取值范圍 。
(3)m=4.6時(shí),Zn與酸反應(yīng)產(chǎn)生H2的質(zhì)量與金屬質(zhì)量(m)的關(guān)系如圖。請(qǐng)?jiān)趫D中再畫出鈉和鎂二種金屬分別與酸反應(yīng)產(chǎn)生H2的質(zhì)量與金屬質(zhì)量(m)的關(guān)系圖線。(在圖線上用元素符號(hào)注明)
1.將等質(zhì)量的鎂、鐵、鋅分別放入三份質(zhì)量分?jǐn)?shù)相同的稀鹽酸中,反應(yīng)生成的氫氣質(zhì)量與反應(yīng)時(shí)間的關(guān)系如圖所示。根據(jù)圖中信息,下列判斷正確的是( )
A.曲線y表示鎂的反應(yīng)情況
B.鎂一定過(guò)量
C.鋅一定過(guò)量
D.鎂消耗稀鹽酸的質(zhì)量最大
2.將質(zhì)量相等的A、B、C三種金屬,同時(shí)分別放入三份溶質(zhì)質(zhì)量分?jǐn)?shù)相同且足量的稀鹽酸中,反應(yīng)生成H2的質(zhì)量與反應(yīng)時(shí)間的關(guān)系如圖所示。根據(jù)圖中所提供的信息,得出的結(jié)論錯(cuò)誤的是( )(已知:A、B、C在生成物中均為+2價(jià))
A.放出H2的質(zhì)量是A>B>C
B.金屬活動(dòng)性順序是A>B>C
C.反應(yīng)速率最大的是B
D.相對(duì)原子質(zhì)量是C>B>A
3.等質(zhì)量的稀硫酸分別與足量的鎂、鐵、鋅三種金屬反應(yīng),下列圖象能正確生產(chǎn)氫氣質(zhì)量與反應(yīng)時(shí)間之間關(guān)系的是( )
A. B.
C. D.
4.鋅和稀H2SO4反應(yīng)生成H2,幾次實(shí)驗(yàn)鋅的用量不同,H2SO4用量相同,鋅的用量和生成H2的體積(同溫、同壓)的關(guān)系如圖所示:
①鋅和過(guò)量的H2SO4反應(yīng)在圖中的 處
②鋅與適量的H2SO4恰好完全反應(yīng)在圖中 處
③過(guò)量的鋅和H2SO4反應(yīng)表示在圖中的 處.
5.將質(zhì)量均為10克的Mg、Fe、Zn三種金屬分別放入質(zhì)量和溶質(zhì)質(zhì)量分?jǐn)?shù)均相同的三份稀硫酸中,反應(yīng)完全后,生成氫氣的質(zhì)量關(guān)系不可能的是 。其中A表示的是 。
6.已知某金屬粉末中除含有Al外還含有一定量的Fe,為測(cè)定金屬的含量,某化學(xué)興趣小組的同學(xué)展開(kāi)了如下的實(shí)驗(yàn)探究。
小資料:Al與氫氧化鈉溶液反應(yīng)生成溶于水的偏鋁酸鈉和氫氣(反應(yīng)的化學(xué)方程式為:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,F(xiàn)e不與氫氧化鈉溶液反應(yīng))。
取20g該金屬粉末,把100g氫氧化鈉溶液平均分成5份依次加入,充分反應(yīng)后,過(guò)濾出固體,將其洗滌、干燥、稱量。實(shí)驗(yàn)過(guò)程中得到的部分?jǐn)?shù)據(jù)與圖像如下:
加NaOH溶液的次數(shù) 第一次 第二次 第三次 第四次 第五次
剩余固體的質(zhì)量/g 16.5 13 9.5 m n
(1)第五次加入NaOH后,溶液中的溶質(zhì)是 。
(2)結(jié)合圖表分析,上表中m的值為 。
(3)Fe的質(zhì)量分?jǐn)?shù)為 。
(4)所用氫氧化鈉溶液的溶質(zhì)質(zhì)量分?jǐn)?shù)為多少?(精確到0.1%)
答案及解析
例1、B解:A、最終稀硫酸完全反應(yīng),生成氫氣質(zhì)量相等,該選項(xiàng)對(duì)應(yīng)關(guān)系不正確;
B、最終稀硫酸完全反應(yīng),生成氫氣質(zhì)量相等,鎂比鋅活潑,鋅比鐵活潑,因此鎂反應(yīng)時(shí)間最短,鐵反應(yīng)時(shí)間最長(zhǎng),該選項(xiàng)對(duì)應(yīng)關(guān)系正確;
C、最終稀硫酸完全反應(yīng),生成氫氣質(zhì)量相等,鎂比鋅活潑,鋅比鐵活潑,因此鎂反應(yīng)時(shí)間最短,鐵反應(yīng)時(shí)間最長(zhǎng),該選項(xiàng)對(duì)應(yīng)關(guān)系不正確;
D、最終稀硫酸完全反應(yīng),生成氫氣質(zhì)量相等,該選項(xiàng)對(duì)應(yīng)關(guān)系不正確。
故選:B。
例2、解:(1)鋁和鋅都能和酸反應(yīng)生成氣體,銀和酸不反應(yīng),一定不是銀,則可能是鋅和鋁的一種或兩種,兩種金屬和酸反應(yīng)都有氣泡產(chǎn)生,故答案為:氣泡;
(2)設(shè)生成0.2g氫氣需要鋅的質(zhì)量為m
Zn+H2SO4=ZnSO4+H2↑
65 2
m 0.2g
m=6.5g
答:a點(diǎn)對(duì)應(yīng)的鋅的質(zhì)量m為6.5g。
(3)由圖像可知,生成0.2g氫氣,需要鋁的質(zhì)量小于2g,故“銀粉”是鋁粉,設(shè)50g硫酸中硫酸的溶質(zhì)質(zhì)量分?jǐn)?shù)為y
2Al+3H2SO4═Al2(SO4)3+3H2↑
294 6
50g×x 0.2g
x=19.6%
答:實(shí)驗(yàn)中所用稀硫酸的溶質(zhì)質(zhì)量分?jǐn)?shù)為19.6%。
例3、解:(1)與等質(zhì)量等濃度的同種酸反應(yīng),當(dāng)同種金屬的質(zhì)量相同時(shí),粉末狀的要比塊狀的反應(yīng)快,則以上反應(yīng)中,鎂和鎳還需要控制與酸的接觸面積相同;故答案為:與酸的接觸面積;
(2)A、甲中稀硫酸過(guò)量,反應(yīng)結(jié)束后,金屬無(wú)剩余,正確;
B、乙中金屬過(guò)量,酸無(wú)剩余
Mg+H2SO4=MgSO4+H2↑ Ni+H2SO4=NiSO4+H2↑
98 2 98 2
從上式可知:每98份質(zhì)量的硫酸與鎂(鎳)反應(yīng)生成。生成2份質(zhì)量的氫氣,錯(cuò)誤;
C、甲生成氫氣質(zhì)量不同,消耗的稀硫酸質(zhì)量不同,正確;
D、根據(jù)以上分析,乙生成氫氣質(zhì)量相同,消耗的稀硫酸質(zhì)量相同,正確;
故選:ACD;
(3)設(shè)鎂的質(zhì)量為a。
Mg+H2SO4=MgSO4+H2↑
24 2
a 0.57g
a=6.84g
鎳與鎂的質(zhì)量相等:鎳的質(zhì)量也為6.84g
設(shè)生成6.84g鎳生成氫氣的質(zhì)量為b,消耗稀硫酸質(zhì)量為c。
Ni+H2SO4=NiSO4+H2↑
58.7 2
6.84g b
b≈0.23g
c=115g
畫圖如下:;故答案為:
1.B
解:A、鋅和稀鹽酸反應(yīng)生成氯化鋅和氫氣,隨著反應(yīng)進(jìn)行,氫氣質(zhì)量增大,完全反應(yīng)后氫氣質(zhì)量不再變化,該選項(xiàng)正確。
B、完全反應(yīng)后繼續(xù)加入稀鹽酸時(shí),溶液質(zhì)量仍然增大,該選項(xiàng)不正確。
C、隨著反應(yīng)進(jìn)行,氯化鋅質(zhì)量增大,完全反應(yīng)后氯化鋅質(zhì)量不再變化,該選項(xiàng)正確。
D、鋅完全反應(yīng)后,消耗鋅的質(zhì)量不再變化,該選項(xiàng)正確。
故選:B。
2.B
解:A、因?yàn)殇\最活潑,反應(yīng)時(shí)間少,則圖線X表示鋅的反應(yīng)情況,故正確;
B、因?yàn)?種金屬生成的氫氣質(zhì)量相等,結(jié)合生成的氫氣質(zhì)量金屬的質(zhì)量,可知:鐵一定過(guò)量,鋅可能反應(yīng)完,故錯(cuò)誤;
C、由圖象可知生成氫氣的質(zhì)量相等,故正確;
D、由圖象可知最終鋅、鐵2種金屬生成的氫氣質(zhì)量相等,因?yàn)閰⒓臃磻?yīng)的稀鹽酸的質(zhì)量是相等的,所以鹽酸都已完全反應(yīng),故正確;
故選:B。
3.C
解:由圖像中的數(shù)據(jù),1.2g鎂會(huì)生成0.10g氫氣,3.25g鋅會(huì)生成0.10g氫氣,2.3g的鈉會(huì)生成0.10g的氫氣。
①Na、Mg、Zn 三種金屬活動(dòng)性都排在氫前,都能置換出酸中的氫,正確;
②生成相同質(zhì)量的氫氣消耗金屬的質(zhì)量為Mg<Na<Zn,錯(cuò)誤;
③由圖像可知,生成相同質(zhì)量的氫氣消耗 Na、Mg、Zn 三種金屬的質(zhì)量Mg<Na<Zn,生成相同質(zhì)量的氫氣消耗 Na、Mg、Zn 三種金屬的質(zhì)量比不可能是23:24:65,三種金屬質(zhì)量比為46:24:65,錯(cuò)誤;
④生成相同質(zhì)量的氫氣消耗 Na、Mg、Zn 三種金屬的原子個(gè)數(shù)比為2:1:1,正確;
故選:C。
4.解:(1)對(duì)鋅片而言,0~t2段的時(shí)間里表示其與鹽酸反應(yīng),氫氣質(zhì)量增加,鋅片的質(zhì)量減少。
故答案為:減少。
(2)A、B曲線有部分重合,即m1所對(duì)應(yīng)的部分,m1表示t2時(shí)產(chǎn)生的氫氣質(zhì)量。
故答案為:t2。
(3)鋅粉與鹽酸的反應(yīng)速率比鋅片快,說(shuō)明其它條件相同時(shí),金屬的顆粒越小,反應(yīng)速率越快。
故答案為:其它條件相同時(shí),金屬的顆粒越小,反應(yīng)速率越快。
(4)影響金屬與鹽酸反應(yīng)快慢的合理因素還有鹽酸濃度等,即其它條件相同時(shí),鹽酸濃度越大,反應(yīng)速率越快。
故答案為:鹽酸濃度。
5.解:(1)Na>Mg>Zn、Na=Mg>Zn、Mg>Na>Zn、Mg>Na=Zn
解析:此題的特殊之處在于:鈉既可以與酸反應(yīng)還可以與水反應(yīng),鎂、鋅只與酸反應(yīng)而不與水反應(yīng)。質(zhì)量均為m g的鈉、鎂、鋅三種金屬與酸(過(guò)量)完全反應(yīng)時(shí)產(chǎn)生氫氣的質(zhì)量分別為:m g/23、m g/12、2m g/65.由此可以看出,鈉、鎂、鋅三種金屬與等量酸恰好完全反應(yīng)(或生成等質(zhì)量的氫氣)時(shí),所消耗的金屬質(zhì)量關(guān)系為:m(鋅)>m(Na)>m(Mg),于是:
①酸過(guò)量(酸與鎂恰好完全反應(yīng))時(shí),產(chǎn)生的氫氣質(zhì)量的情況為:Mg>Na>Zn;
②鈉、鎂、鋅均過(guò)量(或鋅恰好完全反應(yīng))時(shí),過(guò)量的鈉可以水反應(yīng)而產(chǎn)生的氫氣質(zhì)量最多,鎂、鋅產(chǎn)生的氫氣質(zhì)量因受酸的限制而相等:Na>Mg=Zn;
③鈉、鎂均過(guò)量而鋅不足時(shí),產(chǎn)生的氫氣質(zhì)量的情況為:Na>Mg>Zn;
④鎂過(guò)量、鈉恰好與酸完全反應(yīng),而鋅不足時(shí):Na=Mg>Zn;
(2)m≥3.25;
解析:由上面的分析可知:當(dāng)產(chǎn)生的氫氣的質(zhì)量大小為Na>Mg=Zn時(shí),鈉、鎂、鋅均應(yīng)過(guò)量(或鋅恰好完全反應(yīng)),因此m的大小只取決于鋅的質(zhì)量。
設(shè):25 g 質(zhì)量分?jǐn)?shù)為19.6% 的稀硫酸與鋅恰好完全反應(yīng)消耗鋅的質(zhì)量為χ
Zn+H2SO4═ZnSO4+H2↑
65 98
χ 25 g×19.6%
65:98=χ:25 g×19.6% 解得:χ=3.25g
故:m≥3.25
(3)解析:m=4.6 時(shí),m>3.25.因此鈉、鎂、鋅均過(guò)量,鈉在酸消耗完后還可以與水反應(yīng),產(chǎn)生氫氣的量由鈉決定:2Na+H2SO4=Na2SO4+H2↑ 2Na+2H2O=2NaOH+H2↑,
設(shè):鈉產(chǎn)生的氫氣質(zhì)量的y
2Na﹣﹣﹣﹣H2
46 2
4.6g y
46:2=4.6g:y 解得:y=0.2g
鎂、鋅產(chǎn)生的氫氣質(zhì)量因受酸的限制而相等,由上圖可知:均為0.1g。
設(shè):25 g 質(zhì)量分?jǐn)?shù)為19.6% 的稀硫酸與鎂恰好完全反應(yīng)消耗鎂的質(zhì)量為z
Mg+H2SO4═ZnSO4+H2↑
24 98
Z 25 g×19.6%
24:98=z:25 g×19.6%
解得:z=1.2 g
故答案為:(1)Mg>Na>Zn、Na>Mg=Zn、Na>Mg>Zn、Na=Mg>Zn;
(2)m≥3.25;
(3)
1.B解:觀察圖象可知,三種金屬反應(yīng)的速率x>y>z,判斷出三種金屬的活動(dòng)性順序?yàn)閤>y>z,從而得知x為鎂,y為鋅,z鐵。相同質(zhì)量的三種金屬完全參加反應(yīng),應(yīng)該是鎂消耗的酸最多,鐵次之,鋅最少,但圖中鐵產(chǎn)生氫氣最多,即消耗稀鹽酸最多;鎂鋅產(chǎn)生氫氣一樣多,即消耗稀鹽酸一樣多,故鎂過(guò)量,但鋅無(wú)法確定。由上述分析可知,B判斷正確。
故選:B。
2.B解:A、由圖中信息可知,放出H2的質(zhì)量是A>B>C,該選項(xiàng)說(shuō)法正確;
B、由圖中信息可知,等質(zhì)量的金屬與足量的酸反應(yīng)時(shí),所需時(shí)間越短,金屬的活動(dòng)性越強(qiáng),所以金屬活動(dòng)性順序是B>A>C,該選項(xiàng)說(shuō)法不正確;
C、由圖中信息可知,反應(yīng)速率最大的是B,該選項(xiàng)說(shuō)法正確;
D、A、B、C在生成物中均為+2價(jià),因此反應(yīng)的化學(xué)方程式中化學(xué)計(jì)量數(shù)完全一致,因此將質(zhì)量相等的A、B、C三種金屬,同時(shí)分別放入三份溶質(zhì)質(zhì)量分?jǐn)?shù)相同且足量的稀鹽酸中時(shí),相對(duì)原子質(zhì)量越小,產(chǎn)生的氫氣越多,由圖中信息可知,放出H2的質(zhì)量是A>B>C,所以相對(duì)原子質(zhì)量是C>B>A,該選項(xiàng)說(shuō)法正確。
故選:B。
3.B解:A、圖中所示,充分反應(yīng)后所得氫氣質(zhì)量不等,與實(shí)驗(yàn)分析不一致,故A不正確;
B、圖中所示,充分反應(yīng)后放出氫氣質(zhì)量相等,并且與鐵充分反應(yīng)所需要時(shí)間最長(zhǎng)、與鎂反應(yīng)時(shí)間最短,與實(shí)驗(yàn)分析相符,故B正確;
C、圖中所示,充分反應(yīng)后產(chǎn)出氫氣質(zhì)量相等,但與鋅反應(yīng)的時(shí)間最長(zhǎng),不符合金屬活動(dòng)性強(qiáng)弱關(guān)系,故C不正確;
D、圖中所示,充分反應(yīng)后所產(chǎn)生氫氣質(zhì)量不等,與實(shí)驗(yàn)分析不一致,故D不正確;
故選:B。
4.解:由鋅與稀硫酸的反應(yīng),觀察圖象可知,
①鋅和過(guò)量的H2SO4反應(yīng),在鋅未反應(yīng)完時(shí),生成的氫氣的質(zhì)量不斷增加,當(dāng)鋅全部參加反應(yīng)時(shí)生成的氫氣最多,在圖中的O﹣A處;
②當(dāng)鋅與適量的H2SO4恰好完全反應(yīng)時(shí),生成的氫氣最多,在圖中A處;
③過(guò)量的鋅和H2SO4反應(yīng)時(shí),不在產(chǎn)生氫氣,氫氣的質(zhì)量達(dá)到最大,同時(shí)也是定值,在圖中的 A﹣B處.
故答案為:①O﹣A;②A;③A﹣B
5.解:A、當(dāng)鹽酸完全反應(yīng)時(shí),生成氫氣質(zhì)量相等,該選項(xiàng)對(duì)應(yīng)關(guān)系可能正確;
B、當(dāng)稀鹽酸過(guò)量時(shí),鎂和鹽酸反應(yīng)生成的氫氣最多,鋅和鹽酸反應(yīng)生成的氫氣最少,該選項(xiàng)對(duì)應(yīng)關(guān)系可能正確;
C、當(dāng)鐵恰好和硫酸反應(yīng)時(shí),鎂過(guò)量,鋅不足,鎂、鐵和稀硫酸反應(yīng)生成的氫氣質(zhì)量相等,鋅和稀硫酸反應(yīng)生成的氫氣質(zhì)量小于鎂、鐵和稀硫酸反應(yīng)生成的氫氣質(zhì)量,該選項(xiàng)對(duì)應(yīng)關(guān)系可能正確;
D、當(dāng)鐵、鋅和稀硫酸反應(yīng)生成的氫氣質(zhì)量相等時(shí),鎂和稀硫酸反應(yīng)生成的氫氣質(zhì)量一定和鐵、鋅和稀硫酸反應(yīng)生成的氫氣質(zhì)量相等,該選項(xiàng)對(duì)應(yīng)關(guān)系不可能正確。
故填:D;金屬過(guò)量。
6.解:(1)分析以上數(shù)據(jù)可知,第一次反應(yīng)用去3.5g固體,第二次,也應(yīng)反應(yīng)掉3.5g,所以上表中m的值為6,也說(shuō)明第四次為恰好完全反應(yīng),第五次加入NaOH后,氫氧化鈉過(guò)量,溶液中的溶質(zhì)是NaOH、NaAlO2;
(2)由分析可知,m的值為6;
(3)由圖可知,鐵的質(zhì)量為6g,F(xiàn)e的質(zhì)量分?jǐn)?shù)為100%=30%;
(4)設(shè)氫氧化鈉溶液中溶質(zhì)質(zhì)量分?jǐn)?shù)為x.
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
54 80
20g﹣6g 80gx
解得:x≈25.9%
答:氫氧化鈉溶液中溶質(zhì)質(zhì)量分?jǐn)?shù)為25.9%。
故答案為:(1)NaOH、NaAlO2;(2)6;(3)30%;(4)25.9%。
2023-2024學(xué)年上學(xué)期浙教版科學(xué)九年級(jí)“沖刺重高”講義(十五)
氫氣制取的圖像分析
展開(kāi)更多......
收起↑
 資源預(yù)覽
資源預(yù)覽