資源簡介
資源簡介
第一章 有機化合物的結構特點與研究方法
第二節 研究有機化合物的一般方法 課時1
青蒿素結構的測定
科學·技術·社會
20世紀70年代初,我國屠呦呦等科學家使用乙醚從中藥中提取并用色譜分離得到抗瘧有效成分青蒿素,隨后展開了對青蒿素分子結構的測定和相關醫學研究。科學家們通過元素分析和質譜法分析,確定青蒿素的相對分子質量為282,分子式為C15H22O5。經紅外光譜和核磁共振譜分析,確定青蒿素分子中含有酯基和甲基等結構片段。通過化學反應證明其分子中含有過氧基(—O—O—)。1975年底,我國科學家通過X射線衍射最終測定了青蒿素的分子結構。
研究有機物的一般步驟:
蒸餾、萃取、重結晶等
元素定量分析
質譜法
紅外光譜、核磁共振氫譜、X射線衍射譜
每一個操作步驟是怎樣完成的呢?
分離、提純
確定實驗式
確定分子結構
確定分子式
1.了解研究有機化合物的一般方法,能說出研究有機化合物的主要步驟;
2.能依據有機化合物分離和提純的原理,以及有機化合物自身的性質,選擇分離和提純的方法,并能初步學會分離和提純的基本操作;
3.通過苯甲酸重結晶的實驗探究,感受科學研究的方法。
一、有機化合物的分離、提純
提純含雜質的有機化合物的基本方法是利用有機化合物與雜質物理性質的差異將它們分離。在有機化學中常用的分離和提純方法有蒸餾、萃取和重結晶等。
分離提純的基本原則:
不增:
不減:
易分離:
易復原:
不引入新雜質
不減少被提純物
雜質轉換為沉淀、氣體等容易分離除去
被提純物易復原
1.蒸餾
(1)蒸餾的原理
利用混合物的沸點不同,除去難揮發或不揮發的雜質
(2)蒸餾提純的條件
①被提純有機物熱穩定性較強;
②與雜質的沸點相差較大(一般約大于30℃)
(常用于分離、提純液態有機物)
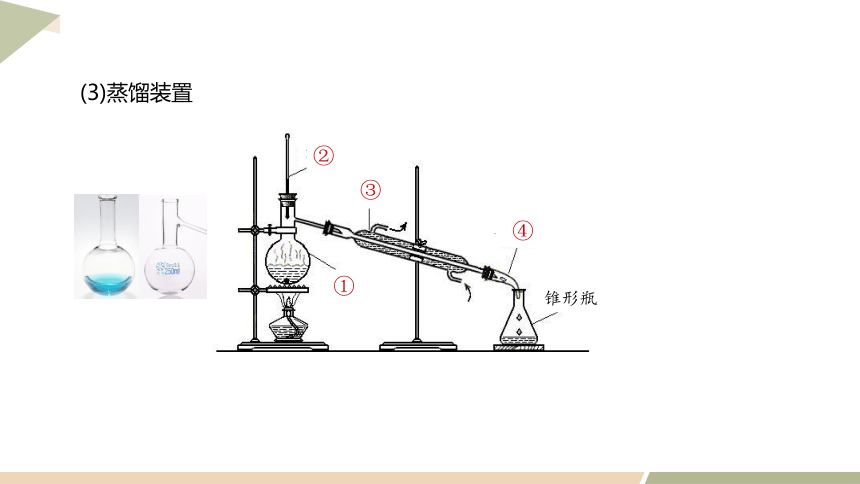
蒸餾燒瓶
溫度計
冷凝管
牛角管
錐形瓶
①
②
③
④
(3)蒸餾裝置
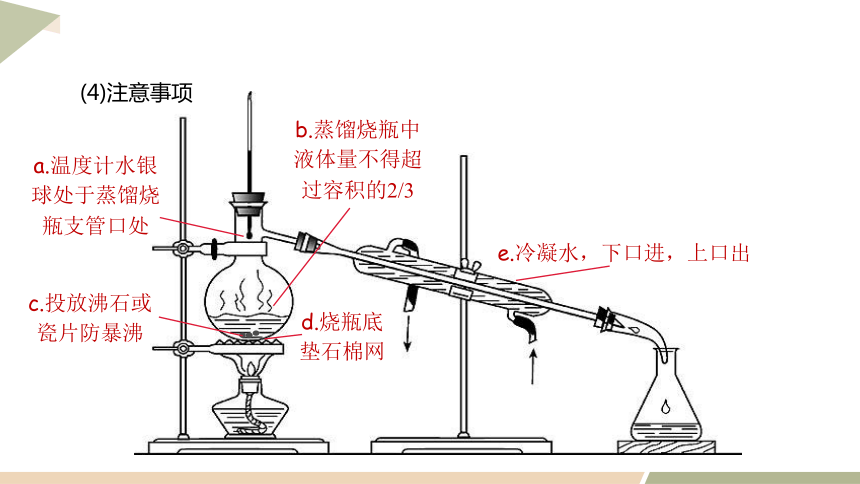
c.投放沸石或瓷片防暴沸
d.燒瓶底
墊石棉網
e.冷凝水,下口進,上口出
b.蒸餾燒瓶中液體量不得超過容積的2/3
a.溫度計水銀球處于蒸餾燒瓶支管口處
(4)注意事項
思考與討論
Ⅰ.分離液態混合物中含二氯甲烷、三氯甲烷和四氯化碳的方法是什么?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 產物
二氯甲烷
三氯甲烷
四氯化碳
沸點
40℃
62℃
77℃
甲烷與氯氣發生取代反應,反應歷程如下:
蒸餾
2.萃取
(1)萃取的原理
液-液萃取
:利用有機物在兩種互不相溶的溶劑中的溶解性不同,
將有機物從一種溶劑轉移到另一種溶劑中的過程
固-液萃取
:用有機溶劑從固體混合物中溶解出有機物的過程
(2)萃取劑
的選擇
①萃取劑與原溶液中的溶劑不反應,不互溶;
②溶質在萃取劑中的溶解度大于在原溶劑中的溶解度
③萃取劑與溶質不反應
常用的萃取劑有:乙醚、乙酸乙酯、
二氯甲烷等。
(3)分液
:將萃取后兩種互不相溶的液體分開的操作,常要使用分液漏斗。
梨形分液漏斗
球形分液漏斗
控制液體的流量
瓶塞(玻璃塞)
凹槽、小孔
活塞
分液漏斗使用前要檢漏
(4)主要實驗步驟:
加萃取劑,充分振蕩
靜置分層
打開分液漏斗活塞,從下口將下層液體放出
及時關閉活塞,上層液體從上口倒出
3.重結晶
(提純固體有機化合物常用的方法)
(1)原理
:利用被提純物質與雜質在同一溶劑中的溶解度不同而將雜質除去。
(2)溶劑要求
③被提純的有機化合物在此溶劑中的溶解度受溫度影響較大,
高溫時,溶解度大,低溫時,溶解度小,冷卻后易于結晶析出。
②雜質在此溶劑中溶解度很小或者很大,易于除去。
①不與被提純物質發生化學反應
如果重結晶所得的晶體純度不能達到要求,可以再次進行重結晶以提高產物的純度。
探究:重結晶法提純苯甲酸
【問題】某粗苯甲酸樣品中含有少量氯化鈉和泥沙,提純苯甲酸需要經過
哪些步驟?
{5940675A-B579-460E-94D1-54222C63F5DA}溫度/℃
25
50
75
溶解度/g
0.34
0.85
2.2
資料:苯甲酸可用作食品防腐劑。純凈的苯甲酸為無色結晶,其結構可表示為 ,熔點12℃,沸點29℃。苯甲酸微溶于水,易溶于乙醇等有機溶劑。苯甲酸在水中的溶解度如下
【實驗】
(1)觀察粗苯甲酸樣品的狀態。
(2)將1g粗苯甲酸放入100mL燒杯,加入50mL蒸餾水。加熱,攪拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁熱將溶液過濾至另一燒杯中,將濾液靜置,使其緩慢冷卻結晶。
(4)待濾液完全冷卻后濾出晶體,并用少量蒸餾水洗滌。將晶體鋪在干燥的濾紙上,晾干后稱其質量。
【討論】
(1)重結晶法提純苯甲酸的原理是什么?有哪些主要操作步驟?
(2)溶解粗苯甲酸時加熱的作用是什么?趁熱過濾的目的是什么?
(1)雜質:泥沙難溶于水,氯化鈉易溶于水,苯甲酸的溶解度受溫度影響比較大。
步驟:加少量熱水溶解,趁熱過量,除去泥沙,冷卻結晶,過濾。
(2)加熱:使苯甲酸溶解。趁熱過濾:除去泥沙,并防止苯甲酸晶體低溫析出。
(3)實驗操作中多次使用了玻璃棒,分別起到了哪些作用?
(4)如何檢驗提純后的苯甲酸中氯化鈉已經被除凈?
(3)玻璃棒:加熱溶解——攪拌,加速苯甲酸溶解
過濾——引流
(4)取少量晶體溶于水,加入硝酸酸化的硝酸銀溶液,若無白色沉淀生成,證明NaCl已經被除凈。
1.在蒸餾實驗中,下列敘述不正確的是( )
A.在蒸餾燒瓶中放入幾粒碎瓷片,防止液體暴沸
B.將溫度計水銀球放在蒸餾燒瓶支管口附近
C.冷水從冷凝管下口入,上口出
D.蒸餾燒瓶不用墊石棉網,可直接加熱
D
[練一練]
2.下列說法中錯誤的是( )
A.用酒精萃取甲苯水溶液中甲苯的操作可選用分液漏斗,然后靜置分液
B.進行分液時,分液漏斗中的下層液體從下口放出,上層液體從上口倒出
C.對于密度不同、互不相溶的液體混合物,可采用分液的方法將它們分離
D.對于熱穩定性較強、沸點較高的液態有機物和沸點較低的雜質可用蒸餾法除雜
A
3.下列有關苯甲酸重結晶實驗中操作說法正確的是( )
A.粗苯甲酸加熱溶解后可以直接趁熱過濾
B.趁熱過濾中,為了防止苯甲酸結晶,可先將漏斗進行預熱
C.趁熱過濾后,為了析出更多晶體,熱濾液用冰鹽水充分冷卻,同時縮短結晶的時間
D.溫度越低,苯甲酸的溶解度越小,所以溫度越低越有利于苯甲酸的重結晶實驗
B
4.現有3組混合物:①乙酸乙酯和乙酸鈉溶液、②乙醇和丁醇、③溴化鈉和單質溴的水溶液,分離以上各組混合物的正確方法依次是( )
A.分液法、萃取法、蒸餾法 B.萃取法、蒸餾法、分液法
C.分液法、蒸餾法、萃取法 D.蒸餾法、萃取法、分液法
C
分離
提純
蒸餾
萃取
重結晶
原理
原理
原理
條件
蒸餾裝置
利用混合物的沸點不同,除去難揮發或不揮發的雜質
注意事項
被提純有機物熱穩定性較強
與雜質的沸點相差較大
萃取劑的選擇
實驗步驟
萃取劑與原溶液中的溶劑不反應,不互溶
溶質在萃取劑中的溶解度大于在原溶劑中的溶解度
萃取劑與溶質不反應
溶劑要求
雜質在此溶劑中溶解度很小或者很大,易于除去
被提純的有機化合物在此溶劑中的溶解度受溫度影響較大
不與被提純物質發生化學反應
展開更多......
收起↑
 資源預覽
資源預覽