資源簡介
資源簡介
(共38張PPT)
章末復習
1.能說出晶體與非晶體的區別;能結合實例描述晶體中微粒排列的周期性規律;
2.能借助分子晶體、共價晶體、離子晶體、金屬晶體等模型說明晶體中的微粒及其微粒間的相互作用;
3.能說明分子光譜、X射線衍射等實驗手段在物質結構研究中的作用;
4.能舉例說明物質在原子、分子、超分子、聚集態等不同尺度上的結構特點對物質性質的影響以及結構研究對于發現、制備新物質的作用。
1.晶體的特性
知識點一:認識晶體
(1)自范性:在適宜條件下,晶體能夠自發地呈現封閉的、規則的多面體外形。
(2)各向異性:晶體在不同的方向上表現出不同的物理性質。
(3)固定的熔、沸點:晶體有固定的熔點,非晶體沒有固定的熔點:
(4)使X射線產生衍射:利用這種性質,人們建立了測定晶體的重要實驗方法。
2.晶胞
(1)定義:
(2)形狀:
(3)晶胞微粒數目的計算:
如某個粒子為x個晶胞所共有,則該粒子有 屬于一個晶胞。
晶體結構中基本的重復單元叫做晶胞。
平行六面體
切割法
知識點二:幾種簡單的晶體結構模型
分類依據 晶體內部微粒的種類和微粒間的相互作用
晶體類型 離子晶體 金屬晶體 共價晶體 分子晶體
構成微粒
微粒間作用力
金屬陽離子、“自由電子”
陰、陽離子
原子
分子間作用力
離子鍵
金屬鍵
共價鍵
分子
1.金屬晶體
(1)定義:
(2)特征:
金屬鍵沒有方向性和飽和性。金屬晶體可以看做等徑圓球的堆積。
(3)常見金屬晶體的結構:
面心立方晶胞
體心立方晶胞
六方晶胞
金屬原子通過金屬鍵形成的晶體。
(4)金屬熔點和硬度大小的影響因素:
(1)金屬的熔點、硬度等取決于金屬晶體內部作用力的強弱。一般來說金屬原子的價電子數越多,原了半徑越小,金屬晶體內部作用力越強,因而晶體熔點越高、硬度越大。金屬晶體的熔點變化差別較大。
(2)同類型金屬晶體,金屬晶體的熔點由金屬陽離子半徑、離子所帶的電荷決定,陽離子半徑越小,所帶電荷越多,相互作用力就越大,熔點就越高。如熔點:Li>Na>K>Rb>Cs,Na
(1)定義:
(2)特征:
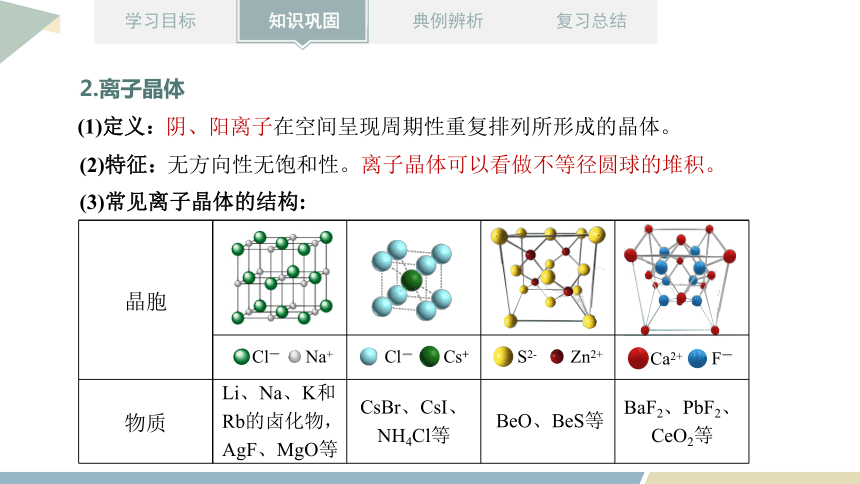
無方向性無飽和性。離子晶體可以看做不等徑圓球的堆積。
(3)常見離子晶體的結構:
晶胞
物質
Na+
Cl-
Cs+
Cl-
S2-
Zn2+
Ca2+
F-
Li、Na、K和Rb的鹵化物,AgF、MgO等
CsBr、CsI、NH4Cl等
BeO、BeS等
BaF2、PbF2、CeO2等
陰、陽離子在空間呈現周期性重復排列所形成的晶體。
(4)晶格能:
②意義:
①定義:
吸收的能量越多,晶格能越大,離子間作用力越強,離子晶體越穩定。
③影響因素:
離子電荷數:離子所帶電荷數越多,晶格能越大。
與離子晶體的結構型式有關。
核間距:陰、陽離子核間距越小,晶格能越大。
靜電作用
晶格能越大,離子晶體的熔點越高
將1mol離子晶體完全氣化為氣態陰、陽離子所吸收的能量。
3.共價晶體
(1)定義:
(2)常見共價晶體的結構:
金剛石 碳化硅 二氧化硅
晶胞
中心原子雜化類型 sp3 sp3 sp3
鍵角 109°28' 109°28' 109°28'
晶胞中微粒數目 8個C C:4個 Si:4個 Si:8個 O:16個
1 mol物質中化 學鍵物質的量 2 mol C—C鍵 2 mol C—Si鍵 4 mol Si—O鍵
相鄰原子間以共價鍵結合而形成的具有空間立體網狀結構的晶體。
4.分子晶體
(1)定義:
(2)常見分子晶體的結構:
碘 二氧化碳 冰
晶胞
①范德華力 無方向性和飽和性
② 氫鍵 具有方向性和飽和性
非密堆積
密堆積
分子之間通過分子間作用力結合形成的晶體。
a.組成結構相似的分子晶體,相對分子質量越大,范德華力越大,熔、沸點越高。
b.相對分子質量相等或相近的分子晶體,極性分子間的范德華力大,相應晶體的熔、沸點高。
c.分子間含有氫鍵的分子晶體,熔、沸點較高。
d.在烷烴的同分異構體中,一般來說,支鏈數越多,熔、沸點越低。
(3)分子晶體熔、沸點高低的比較:
5.混合型晶體
既有共價鍵又有范德華力,同時還存在類似金屬鍵的作用力,兼具共價晶體、分子晶體、金屬晶體特征的晶體,稱為混合型晶體,如石墨。
6.過渡晶體
由于微粒間的作用存在鍵型過渡,即使組成簡單的的晶體,也可能介于離子晶體、共價晶體、分子晶體和金屬晶體之間的過渡狀態,形成過渡晶體。
知識點三:液晶、納米材料與超分子
1.液晶
(1)定義:
在一定的溫度范圍內既具有液體的可流動性,又具有晶體的各向異性(折射率、磁化率、電導率等)的物質。
(2)結構特點:
液晶內部分子的排列沿分子長軸方向呈現出有序的排列,由此在分子長軸的平行方向和垂直方向表現出不同的性質。
(3)液晶性質及用途:
液晶本身不發光,但在電場作用下分子取向會沿電場方向扭曲,通過改變電壓而改變液晶旋光狀態,可以調控通過液晶盒的光強,制造液晶顯示器。
2.納米材料
(1)結構特點:
由直徑為幾或幾十納米的顆粒和顆粒間的界面兩部分組成。通常,納米顆粒內部具有晶狀結構,原子排列有序,而界面則為無序結構。
(2)應用:
納米陶瓷、碳納米管、金屬納米、納米金、磁流體等。
3.超分子
(1)定義:
(2)超分子結合方式:
(3)應用:
若兩個或多個分子相互“組合”在一起形成具有特定結構和功能的聚集體,能表現出不同于單個分子的性質,可以把這種聚集體看成分子層次之上的分子,稱為超分子。
超分子內部分子之間通過非共價鍵相結合,包括氫鍵、靜電作用、疏水作用以及一些分子與金屬離子形成的弱配位鍵等。
①冠醚——分子識別
②分子梭——分子切換
【考點一】晶體與非晶體的區別
【例1】下列敘述中正確的是( )
A.具有規則幾何外形的固體一定是晶體
B.具有特定對稱性的固體一定是晶體
C.具有各向異性的固體一定是晶體
D.依據構成粒子的堆積方式可將晶體分為金屬晶體、離子晶體、分子晶體、共價晶體
C
自發地呈現規則的多面體外形 各向性 熔點
晶體 能 各向異性 固定
非晶體 不能 各向同性 不固定
本質區別 內部微粒在空間是否呈現周期性重復排列
區別方法 間接方法:看是否有固定的熔點
科學方法:對固體進行X射線衍射實驗
晶體與非晶體的區別
1.下列有關晶體和非晶體的說法中正確的是( )
A.無色透明的固體一定是晶體
B.晶體能自發地呈現規則的多面體外形,非晶體不能
C.晶體研碎后即變為非晶體
D.將玻璃加工成規則的固體即變成晶體
【練一練】
B
【考點二】晶胞中原子個數的計算
【例1】某離子晶體晶胞結構如圖所示,X位于立方體的頂點,Y位于立方體中心,試分析:
晶體中每個Y同時吸引著 個X,每個X同時吸引著 個Y,該晶體的化學式為 。
4
8
XY2(或Y2X)
觀察微粒種類→確定微粒在晶胞中的位置→用切割法求各微粒的數目→求各微粒的最簡個數比→確定化學式。
晶胞中原子個數的計算
關鍵是正確分析晶胞中任意位置上的一個原子被幾個晶胞所共用。不同形狀的晶胞情況不同。如六棱柱晶胞中,頂點、側棱、底面、側面的原子,依次被6、3、2、2個晶胞共用。
確定晶體化學式的方法
1.鑭系合金是稀土系儲氫合金的典型代表、由荷蘭菲利浦實驗室首先研制出來。它的最大優點是容易活化。其晶胞結構如圖所示:
則它的化學式為( )
A.LaNi2 B.La2Ni3 C.La2Ni5 D.LaNi5
【練一練】
D
【考點三】四種晶體類型的比較
【例1】(1)下列三種晶體的狀態變化,克服的微粒間的作用力分別是氯化鉀熔化: ;二氧化硅熔化: ;碘的升華: ;三種晶體的熔點由高到低的順序是 。
(2)A、B、C、D為四種晶體,性質如下:
A.固態時能導電,能溶于鹽酸
B.能溶于CS2,不溶于水
C.固態時不導電,液態時能導電,可溶于水
D.固態、液態時均不導電,熔點為3 500 ℃
試判斷它們的晶體類型:
A. ;B. ;C. ;D. 。
金屬晶體 分子晶體 離子晶體 共價晶體
離子鍵
共價鍵
分子間作用力
二氧化硅>氯化鉀>碘
離子晶體 共價晶體 分子晶體 金屬晶體
構成晶體的粒子
粒子間的作用
作用力大小 (一般而言)
判斷作用力大小的參考數據
熔點
四類晶體的比較
陰、陽離子
離子鍵
較強
原子
共價鍵
很強
分子
范德華力(氫鍵)
弱
金屬陽離子
和自由電子
金屬鍵
有的較強,有的較弱
離子電荷數、離子半徑
鍵能、鍵長
(組成、結構相似)相對分子質量
離子半徑、離子所帶電荷數
較高
高
低
差別較大
歸納
離子晶體 共價晶體 分子晶體 金屬晶體
硬度
導熱和 導電性
溶解性
延展性
構成微粒 堆積方式
略硬而脆
大
較小
差別較大
不良導體
(熔融后或溶于水導電)
不良導體
不良導體(部分溶于水,電離后導電)
良導體
多數易溶
一般不溶
相似相溶
一般不溶于水,
少數與水反應
差
差
差
優良
緊密堆積
不遵循緊密堆積原理
一般是緊密堆積
(分子形狀、極性、分子間氫鍵等都會影響分子堆積方式)
緊密堆積
離子晶體 共價晶體 分子晶體 金屬晶體
常見物質
低價態金屬氧化物(如K2O、Na2O等)、強堿(如NaOH、KOH等)和絕大多數的鹽類
大多數非金屬單質(除金剛石、石墨、晶體硅、晶體硼外)、氣態氫化物、非金屬氧化物(除SiO2外),酸、絕大多數有機物
碳化硅、二氧化硅、金剛石、晶體硅、晶體硼等
金屬單質(除汞外)與合金
【練一練】
1.下列晶體分類正確的一組是( )
選項 離子晶體 共價晶體 分子晶體
A NaOH Ar SO2
B H2SO4 石墨 S
C CH3COONa 水晶
D Ba(OH)2 金剛石 玻璃
C
【考點四】晶體熔、沸點高低的比較方法
【例1】下列物質的熔、沸點高低順序正確的是( )
A.二氧化硅>碳化硅
B.MgO>H2O>O2>Br2
C.對羥基苯甲酸>鄰羥基苯甲酸
D.金剛石>生鐵>純鐵>鈉
C
晶體熔、沸點高低的比較方法
(1)不同晶體類型的熔、沸點高低規律
一般為:共價晶體>離子晶體>分子晶體。金屬晶體的熔、沸點差別較大。
(2)同種晶體類型的熔、沸點高低規律
①共價晶體:原子半徑越小,鍵長越短,鍵能越大,晶體的熔、沸點越高。
②離子晶體:離子所帶電荷越多,離子半徑越小,則晶格能越大,晶體熔、沸點越高。
③金屬晶體:金屬原子的價電子數越多,金屬陽離子半徑越小,金屬鍵越強,晶體熔、沸點越高。
④分子晶體:分子間作用力越強,晶體熔、沸點越高。
1.下列晶體中,它們的熔點由低到高的順序排列正確的是( )
①金剛石 ②氯化鈉 ③干冰 ④汞
A.④②③① B.③①②④
C.④②①③ D.③④②①
2.下列物質的熔點高低順序正確的是( )
A.金剛石>晶體硅>碳化硅
B.K>Na>Li
C.NaBr>NaCl>NaF
D.CI4>CBr4>CCl4>CH4
D
D
【練一練】
【考點五】有關晶胞密度的計算
【例1】圖(a)是MgCu2的拉維斯結構,Mg以金剛石方式堆積,八面體空隙和半數的四面體空隙中,填入以四面體方式排列的Cu。圖(b)是沿立方格子對角面取得的截圖。可見,Cu原子之間最短距離x=________pm,Mg原子之間最短距離y=________pm。設阿伏加德羅常數的值為NA,則MgCu2的密度是_____ ___g·cm-3(列出計算表達式)。
a
a
有關晶胞計算的思維流程
注意單位
間的換算
理解晶
胞結構
找出晶胞,晶胞是晶體組成的最基本單位,確定晶胞內所有原子或離子的種類和位置。
確定晶
胞組成
根據晶胞中不同位置的原子或離子對晶胞的不同貢獻,確定一個晶胞的組成,如一個NaCl晶胞相當于4個NaCl。
計算晶
胞質量
根據相對原子質量,計算1mol晶胞質量,然后除以阿伏加德羅常數得到一個晶胞的質量。
確定晶
胞體積
常見晶體的晶胞多為立方體,利用數學方法,計算一個晶胞的體積。
計算晶
胞密度
利用公式 ,計算晶體的密度。
1.金屬鎢晶體中晶胞的結構模型如圖所示。它是一種體心立方結構。實際測得金屬鎢的密度為ρ g·cm-3,鎢的相對原子質量為M,阿伏加德羅常數的值為NA,假定鎢原子為等直徑的剛性球,請回答下列問題:
(1)每一個晶胞分攤到 個鎢原子。
(2)晶胞的邊長為 cm。
(3)鎢的原子半徑為 cm (只有體對角線上的各個球才是彼此接觸的)。
2
×
【練一練】
【考點六】有關晶胞空間利用率的計算
設鐵原子半徑為r,則該晶體的空間利用率計算式為:
【例1】已知金屬Fe中原子堆積方式如圖1:
×100%
[(2××π×r3)÷(r)3]
空間利用率:指構成晶體的原子、離子或分子在整個晶體空間中所占有的體積百分比。
晶胞中原子空間利用率的計算方法
微粒體積
晶胞體積
晶胞內微粒數目
由晶胞參數計算微粒半徑或由微粒體積計算晶胞參數
1.已知CaF2晶體晶胞的結構如圖所示,Ca2+和F-的半徑分別為a、b。
請回答下列各題:
(1)一個CaF2晶胞中含 個F-, 個Ca2+。
(2)CaF2的空間利用率為 (用a、b表示)。
【練一練】
8 4
×100%
π(4a3+8b3)
16(a+b)3
晶體的特性
晶體與非晶體的本質區別
晶體與非晶體的區分方法
晶胞
切割法計算晶胞微粒數
金屬晶體
離子晶體
共價晶體
分子晶體
混合型晶體
過渡晶體
定義
結構特點
應用
不同聚集狀態
的物質與性質
認識晶體
幾種簡單的晶體結構模型
液晶、納米材料與超分子
展開更多......
收起↑
 資源預覽
資源預覽