資源簡介
資源簡介
(共15張PPT)
2020畢業論文答辯模板
化學反應與熱能
1.概念
①把 熱量的化學反應稱為放熱反應。
②把 熱量的化學反應稱為吸熱反應。
釋放
吸收
放熱反應
燃燒
金屬與水(或酸)的反應
酸堿中和反應
物質的緩慢氧化
大多數的化合反應
吸熱反應
①大多數分解反應
②C+CO2(以C、H2為還原劑的氧化還原反應)
③Ba(OH)2·8H2O+NH4Cl(固態銨鹽與堿的反應)
④NaHCO3與鹽酸的反應
特別提醒:吸熱反應和放熱反應都是化學變化。
化學反應過程中為什么會有能量的變化?為什么有的化學反應釋放熱量,有的化學反應吸收熱量?
化學反應能量變化的實質
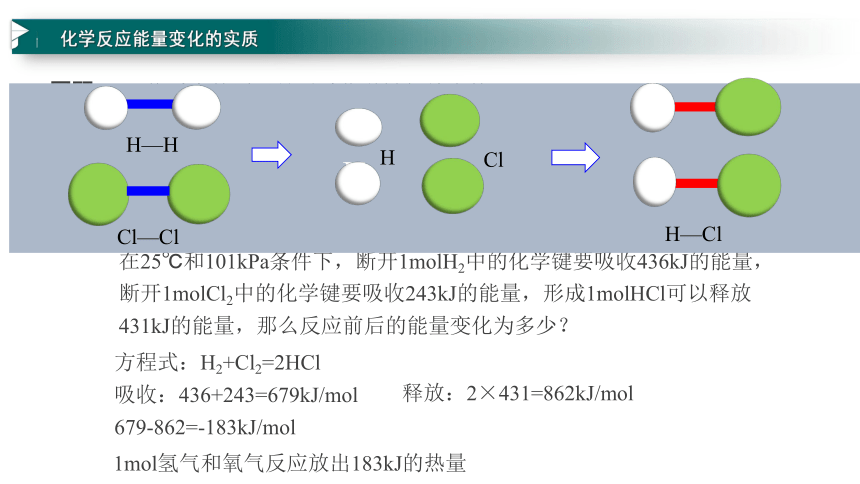
在25℃和101kPa條件下,斷開1molH2中的化學鍵要吸收436kJ的能量,斷開1molCl2中的化學鍵要吸收243kJ的能量,形成1molHCl可以釋放431kJ的能量,那么反應前后的能量變化為多少?
方程式:H2+Cl2=2HCl
吸收:436+243=679kJ/mol
1mol氫氣和氧氣反應放出183kJ的熱量
釋放:2×431=862kJ/mol
679-862=-183kJ/mol
化學反應能量變化的實質
回顧
1.物質中的原子是通過化學鍵相結合的。
2.化學變化的過程本質上就是舊化學鍵斷裂,新化學鍵生成的過程。
新知
斷裂化學鍵需要吸收能量,形成化學鍵需要釋放能量
在25℃和101kPa條件下,斷開1molH2中的化學鍵要吸收436kJ的能量,斷開1molCl2中的化學鍵要吸收243kJ的能量,形成1molHCl可以釋放431kJ的能量,那么反應前后的能量變化為多少?
方程式:H2+Cl2=2HCl
吸收:436+243=679kJ/mol
1mol氫氣和氧氣反應放出183kJ的熱量
H—H
Cl—Cl
H
H
Cl
H—Cl
釋放:2×431=862kJ/mol
679-862=-183kJ/mol
能量
反應過程
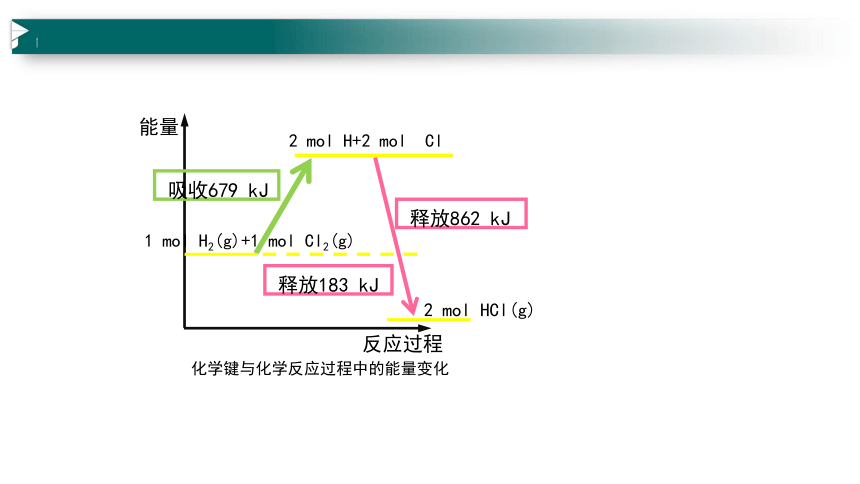
1 mol H2(g)+1 mol Cl2(g)
2 mol H+2 mol Cl
2 mol HCl(g)
吸收679 kJ
釋放862 kJ
釋放183 kJ
化學鍵與化學反應過程中的能量變化
小試牛刀
25℃,101kpa下,已知甲烷中斷裂1molC-H鍵要吸收413kJ能量,斷裂1mol氧氣分子中的化學鍵需要吸收498 kJ能量,水分子中形成1molO-H鍵釋放463.4kJ的能量,二氧化碳分子中形成1molC=O鍵釋放803kJ的能量,請問反應前后能量變化是多少?
方程式:CH4+2O2=CO2+2H2O
甲烷分子:413×4=1652kJ/mol
氧氣分子:498kJ/mol
水分子:2×463.4=926.8kJ/mol
二氧化碳分子:2×803=1606kJ/mol
能量變化:1652+2×498-926.8×2-1606=-811.6kJ/mol
你知道為什么以甲烷為主要成分的天然氣是主要的燃料嗎?
化學反應過程中為什么會有能量的變化?為什么有的化學反應釋放熱量,有的化學反應吸收熱量?
小試牛刀
25℃,101kpa下,已知甲烷中斷裂1molC-H鍵要吸收413kJ能量,斷裂1mol氧氣分子中的化學鍵需要吸收498 kJ能量,水分子中形成1molO-H鍵釋放463.4kJ的能量,二氧化碳分子中形成1molC=O鍵釋放803kJ的能量,請問反應前后能量變化是多少?
方程式:CH4+2O2=CO2+2H2O
甲烷分子:413×4=1652kJ/mol
氧氣分子:498kJ/mol
水分子:2×463.4=926.8kJ/mol
二氧化碳分子:2×803=1606kJ/mol
能量變化:1652+2×498-926.8×2-1606=-811.6kJ/mol
你知道為什么以甲烷為主要成分的天然氣是主要的燃料嗎?
化學反應中的物質變化總會伴隨著能量變化,通常表現為熱量的釋放或吸收。化學鍵的斷裂和形成是化學反應中能量變化的主要原因。若斷裂化學鍵吸收的能量大于形成化學鍵釋放的能量,則反應吸收熱量;反之,反應釋放熱量。
小試牛刀
化學反應中的物質變化總會伴隨著能量變化,通常表現為熱量的釋放或吸收。化學鍵的斷裂和形成是化學反應中能量變化的主要原因。若斷裂化學鍵吸收的能量大于形成化學鍵釋放的能量,則反應吸收熱量;反之,反應釋放熱量。
火箭發射過程中甲烷可以作燃料嗎?為什么?
拓展應用
化學反應能量變化的宏觀解釋
放熱反應可以看成是反應物所具有的化學能轉化為熱能釋放出來,吸熱反應可以看成是熱能轉化為化學能被生成物所“儲存”。
各種物質都具有能量,物質的組成、結構與狀態不同,所具有的能量也不同。
放熱反應
吸熱反應
(1)化學反應中的能量變化取決于反應物總能量和生成物總能量的相對大小,不取決于部分反應物和部分生成物能量的相對大小。
(2)
①吸熱反應不一定需要加熱,需加熱才能發生的化學反應也不一定是吸熱反應;
②放熱反應不一定都常溫發生,常溫下能夠進行的化學反應也不一定是放熱反應。
提醒:
一個反應是放熱還是吸熱與反應開始前是否需要加熱無關
總結
放熱反應 吸熱反應
定義 釋放熱量的化學反應 吸收熱量的化學反應
宏觀 解釋 反應物具有的總能量大于生成物具有的總能量 反應物具有的總能量小于生成物具有的總能量
微觀 解釋 生成物分子成鍵時釋放的總能量大于反應物分子斷鍵時吸收的總能量 生成物分子成鍵時釋放的總能量小于反應物分子斷鍵時吸收的總能量
吸熱反應與放熱反應的比較
總結
一個化學反應是放熱反應還是吸熱反應取決于:
取決于所有斷鍵吸收的總能量與所有形成新鍵放出的總能量的相對大小;
取決于反應物的總能量與生成物的總能量的相對大小。
展開更多......
收起↑
 資源預覽
資源預覽