資源簡介
資源簡介
(共43張PPT)
化學反應的限度
思考?
我們知道在化學反應中,反應物之間是按照化學方程式中的系數比進行反應的,那么,在實際反應中,反應物能否按相應的計量關系完全轉化為生成物呢?
§ 氯水是氯氣的水溶液,氯氣能與水反應,而且這是一個可逆反應。請大家回憶氯水中含有哪些微粒。
氯水的成份:
分子:Cl2 、HClO 、H2O
離子:H+ 、 Cl- 、ClO- 等
Cl2 能 與H2O發生可逆反應:
Cl2 + H2O HClO + HCl
H2 + I2 2HI
正反應
逆反應
(復習)什么叫做可逆反應?
在同一條件下,既向正反應方向進行,
同時又向逆反應方向進行的反應.
典型的可逆反應有: Cl2 + H2O HClO + HCl
N2+3H2 2NH3
催化劑
高溫高壓
2SO2+O2 2SO3
催化劑
高溫
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
啟示:化學反應是有限度的,有些能進行地較徹底,有些反應是不徹底的,甚至是可逆的。
≒
(2)特點:雙向性同時性 共存性2SO2+18O22SO3 可逆反應中反應物能否完全轉化為生成物?其他化學反應在實際進行時,反應物都能完全轉變為生成物?不能!三、化學反應的限度1.可逆反應
(1)定義
在同一條件下 和 均能進行的化學反應。書寫可逆反應的化學方程式時,不用“===”,用“ ”。
知識梳理
正反應方向
逆反應方向
雙向性
雙同性
共存性
反應物 生成物
正、逆反應是在 下同時進行的
反應物和生成物 存在
(2)特征
同一條件
同時
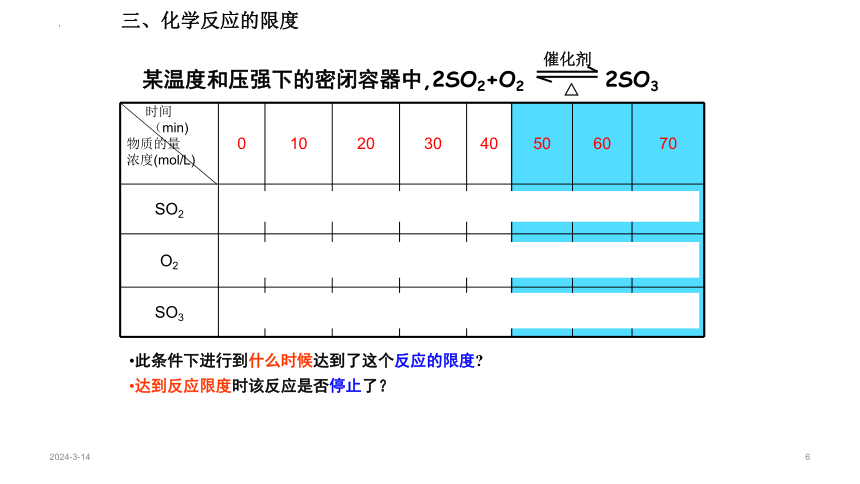
某溫度和壓強下的密閉容器中,2SO2+O22SO3△催化劑時間(min)物質的量濃度(mol/L)010203040506070SO210.70.50.350.20.10.10.1O20.50.350.250.180.10.050.050.05SO300.30.50.650.80.90.90.9此條件下進行到什么時候達到了這個反應的限度 達到反應限度時該反應是否停止了?三、化學反應的限度N2 + H2 NH3
在一固定容積的密閉容器里,加1molN2和
3mol H2 (合適催化劑),能發生什么反應?
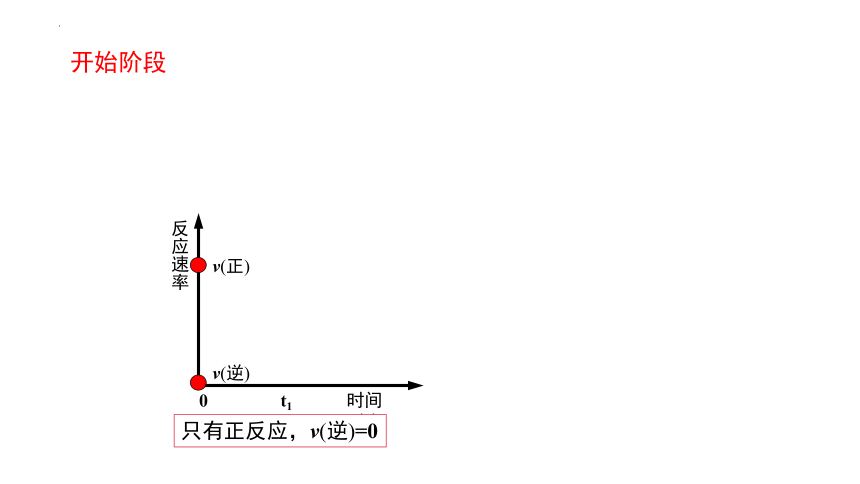
(1)開始時c(N2) 、c(H2)大, c(NH3) =0
開始階段有什么特征?
只有正反應,v(逆)=0
催化劑
N2 + 3 H2 2NH3
高溫
N2 + H2 NH3
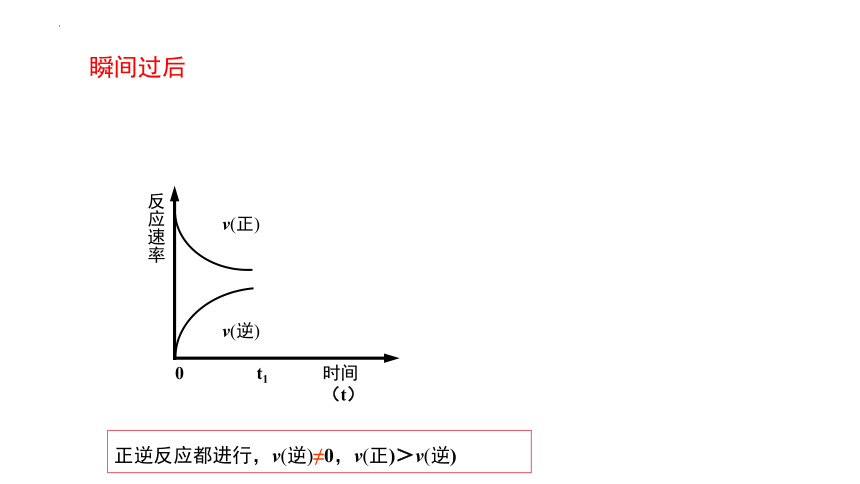
(2)瞬間后c(N2) 、c(H2 )變小 , c(NH3)≠0
瞬間過后有什么特征?
正逆反應都進行,v(逆) ≠0,v(正)> v(逆)
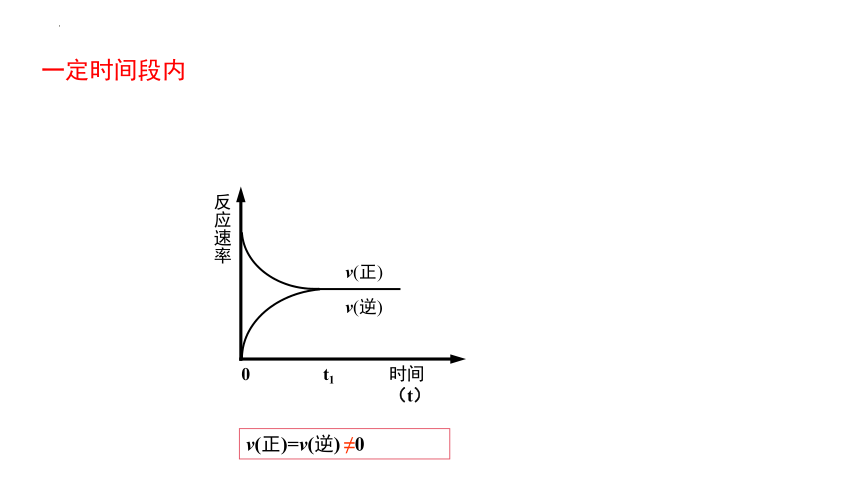
(3)c(N2) 、c(H2)逐漸變小,c(NH3)逐漸增大,
三種物質的濃度達到一個特定值。
一定時間段內有什么特征?
v(正)= v(逆) ≠0
N2 + H2 NH3
開始階段
反應速率
v(正)
v(逆)
t1
時間(t)
0
只有正反應,v(逆)=0
正逆反應都進行,v(逆)≠0,v(正)>v(逆)
瞬間過后
反應速率
v(正)
v(逆)
t1
時間(t)
0
一定時間段內
v(正)
v(逆)
反應速率
t1
時間(t)
0
v(正)=v(逆) ≠0
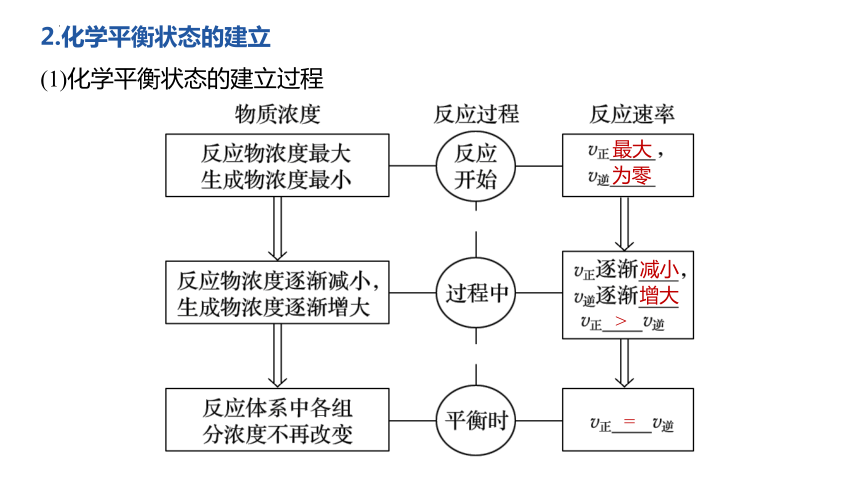
2.化學平衡狀態的建立
(1)化學平衡狀態的建立過程
最大
為零
減小
增大
>
=
由于v(正)= v(逆) ≠0,雖然正、逆反應都在進行,但各種物質的百分含量、濃度都不會發生變化.
從外表上看,反應好象“停止”。
可逆反應的這種特殊狀態就是我們今天要研究的化學平衡狀態。
時間(t)
反應速率
0
t1
v(正)=v(逆)
化學平衡狀態
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
化學平衡建立的過程
v(正)
v(逆)
催化劑
△
2SO2+O2 2SO3
非化學平衡狀態
(1)定義:在一定條件下的可逆反應中,當正反應速率和逆反應速率相等,反應混合物中各組分的濃度保持不變的狀態。前提(適用范圍):可逆反應內在本質:v(正)=v(逆)≠0外在標志:反應混合物中各組分的濃度保持不變2、化學平衡狀態三、化學反應的限度
任務一:化學平衡的特征
化學平衡狀態的特征
化學平衡的特征:“逆”、“等”、“定”、“動”、“變”
(1)“逆”:
化學平衡只存在于可逆反應中;
(2)“等”:
平衡時正反應和逆反應的速率相等且大于0
(3)“定”:
(4)“動”:
化學平衡是一個動態平衡;
(5)“變”:
當條件變化時,原平衡被破壞,在新的條件下會重新建立新的平衡。
平衡時反應物和生成物的濃度保持不變
4.化學反應的限度
(1)化學平衡狀態是可逆反應在一定條件下所能達到或完成的 ,即該反應進行的限度。
(2)對化學反應限度的理解
①化學反應的限度決定了反應物在一定條件下的最大 。
②同一可逆反應,不同條件下,化學反應的限度不同,即改變條件可以在一定程度上改變一個化學反應的 。
最大程度
轉化率
限度
(1)SO2溶于水時,完全與水反應生成H2SO3( )
(2)通過改變反應條件,可逆反應中反應物的轉化率可達100%( )
(3)相同條件下,不同化學反應的限度可能不同( )
(4)一定條件,可以通過延長化學反應的時間來改變反應物的最大轉化率
( )
(5)化學反應在一定條件下建立平衡狀態時,化學反應將會停止( )
判斷正誤
×
×
√
×
×
3、化學平衡狀態的判定
對于可逆反應m A(g) n B(g) + p C(g) 在一定條件下達到平衡狀態有以下幾個標志
(1)A的生成速率和分解速率相等
(2)單位時間生成n mol B和p mol C的同時,生成m mol A
(3)A、B、C的物質的量不再改變
(4)A、B、C的濃度不再改變
(5)A、B、C的百分含量不再改變
直接依據
間接標志:總的物質的量、壓強、密度、顏色
你覺得這些特征中,哪些可以說明一個可逆反應達到了一定條件下的反應限度?
“等”
“定”
如何理解v(正)=v(逆)?
例如,一定條件下,對于可逆反應N2+3H2 2NH3,表示正、逆反應速率可以用N2或H2或NH3來表示:
(1)單位時間內,有1molN2反應掉,同時有1molN2生成
(2)單位時間內,有3molH2反應掉,同時有2molNH3反應掉
(3)單位時間內,有1molN2反應掉,同時有3molH2反應掉
(4)1moN-N鍵斷裂的同時有3moH-H鍵生成
(5)
v正(N2)
2
v逆(NH3)
=
1
任務二:化學平衡的標志
核心:1、有正有逆的描述;2、轉化為統一物質速率相等
如何理解“定”
任務二:化學平衡的標志
核心:一個量隨反應一直變,突然不變
例如,一定條件下,對于可逆反應N2+3H2 2NH3,表示正、逆反應速率可以用N2或H2或NH3來表示:
(1)容器內氮氣的物質的量不再改變
(2)容器內顏色不再改變
(3)固定容器恒容條件下,容器內壓強不再改變
(4)固定容器恒容條件下,容器內氣體密度不再改變
(5)恒容或恒壓條件,容器內平均相對分子質量不再改變
課堂練習
1.一定條件下,向某密閉容器中投入一定量的 X 和 Y ,發生反應 ,反應
過程中正、逆反應速率 v 隨時間 t 的變化情況正確的是( )
A. B.
C. D.
0
v正
v逆
v
t
0
v逆
v正
v
t
0
v正
v逆
v
t
0
v逆
v正
v
t
練習
1、N2+3H2 2NH3反應達到平衡時,下列說法正確的是( )
A、N2和H2不再化合了
B、N2、H2、NH3的濃度相等
C、平衡建立前體系的總質量在不斷變化而平衡建立后體系的總質量就不再變了
D、N2、H2、NH3的濃度保持不變
D
2、下列說法中可以充分說明反應: P(氣)+Q(氣) R(氣)+S(氣) , 在恒溫下已達平衡狀態的是( )
反應容器內壓強不隨時間變化
P和S的生成速率相等
C. 反應容器內P、Q、R、S四者共存
D.反應容器內總物質的量不隨時間而變化
B
3.在密閉容器中進行反應: ,已知 X、Y、Z 的起始濃度分別 為0.1 mol/L、
0.3 mol/L、0.2 mol/L,在一定條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.Z 為 0.3 mol/L B.Y 為 0.4 mol/L
C.X 為 0.2 mol/L D.Z 為 0.4 mol/L
A
歸納總結
化學平衡狀態的判斷依據
(1)直接判斷依據
(2)間接判斷依據
以mA(g)+nB(g) pC(g)+qD(g)為例
類型 判斷依據 平衡狀態
混合物體系中各成分的含量 ①各物質的物質的量或各物質的物質的量分數一定 平衡
②各物質的質量或各物質的質量分數一定 平衡
正、逆反應速率的關系 ①在單位時間內消耗了m mol A同時生成m mol A,即v正=v逆 平衡
②在單位時間內消耗了n mol B同時生成p mol C,則v正不一定等于v逆 不一定
③在單位時間內生成n mol B,同時消耗q mol D,因二者變化均表示v逆,所以v正不一定等于v逆 不一定
溫度 體系溫度一定(其他不變) 平衡
顏色 反應體系內有色物質的顏色一定 平衡
思考:下圖是建筑物的定向爆破,
你從中得到什么啟示?
我們已經知道,在一定條件下,反應會達到限度,那我們在生產生活中都會怎樣去選取合適的反應條件呢?
從反應的速率與反應的限度綜合考慮,以達到促進有利反應,抑制有害反應的目的。
知識梳理
促進
抑制
1 、從化學反應速率考慮——化學反應條件的控制
任務三:化學反應的條件控制
內因 外因
影響方式
反應物濃度
反應溫度
催化劑
接觸面積
濃度越大
速率越快
溫度越高
速率越快
通常加快速率
接觸面積越大
速率越快
氣體壓強
壓強越大(壓縮體積)
速率越快
物質本身的性質
思考與討論
為了提高燃料的燃燒效率,應如何調控燃燒反應的條件?
思考1:煤的狀態與煤燃燒的速率有何關系?與煤的充分燃燒有何關系?
煤被研得越細,粉末越小,與空氣中O2的接觸面積越大,燃燒越充分,反應速率越快。
思考2:空氣用量對煤的充分燃燒有什么影響?原因是什么?
空氣充足,煤燃燒得充分,產物主要為CO2,放熱量大;
空氣不足,則煤燃燒不充分,部分生成CO,CO排放到空氣中造成污染,且生成CO時,放出的熱量大大減小。
思考3:應選擇什么樣的爐(灶)膛材料?理由是什么?
應選擇保溫隔熱且耐熱的爐(灶)膛材料。
盡管煤燃燒是放熱反應,但反應過程中煤燃燒需要提供部分能量才能進行,而利用煤燃燒放出的部分熱量就可維持反應的持續進行。
選用保溫隔熱材料的目的,正式防止熱量散失。
思考4:如何充分利用煤燃燒后的廢氣中的熱量?
可將燃燒后的廢氣通過熱交換裝置,供其他方面使用。
這樣做是為了盡可能充分地利用燃料燃燒所釋放的熱量,提高熱能的利用率。
思考5:燃料不充分燃燒有何危害?
產生熱量少,浪費資源。
產生污染物,危害人體健康。
思考6:燃料充分燃燒的條件是什么?
燃料燃燒必須與空氣接觸,且溫度要達到燃料的著火點。
燃料充分燃燒要考慮到兩點:一是燃燒時要有足夠多的空氣;二是燃料與空氣要有足夠大的接觸面。
2.化工生產中反應條件的調控:
(1)考慮因素:
化工生產中調控反應條件時,需要考慮控制反應條件
的_____和___________。
成本
實際可能性
(2)實例——合成氨生產條件的選擇:
1.下列措施可以提高燃料燃燒效率的是_________(填序號)。
①提高燃料的著火點 ②降低燃料的著火點
③將固體燃料粉碎 ④將液體燃料霧化處理
⑤將煤進行氣化處理 ⑥通入適當過量的空氣
理解應用
③④⑤⑥
解析 理論上,提高燃料燃燒效率的常用方法是增大燃料與空氣的接觸面積,并通入適當過量的空氣。
對于①和②,由于燃料的著火點是其固有的性質,不可改變,故這兩項措施不可行。
③、④、⑤所采取的措施均是為了增大燃料與空氣的接觸面積。
1.將煤塊粉碎、經脫硫處理、在適當過量的空氣中燃燒,這樣處理的目的是
①使煤充分燃燒,提高煤的利用率 ②減少SO2的產生,避免造成“酸雨” ③減少有毒的CO產生,避免污染空氣 ④減少CO2的產生,避免“溫室效應”
A.①②③ B.②③④
C.①③④ D.①②③④
跟蹤強化
1
2
√
解析 煤塊粉碎是為了提高煤的利用率;脫硫是為了減少SO2的產生;過量空氣是為了減少CO的產生。
謝謝!
我們下次見!
展開更多......
收起↑
 資源預覽
資源預覽