資源簡介
資源簡介
(共42張PPT)
2024浙江省中考科學
復習課件
第37講 酸和堿
酸(九上教材P11)
1.酸的定義:電離時所生成的陽離子全部是____的化合物叫
做酸。
2.幾種常見的酸
H+
鹽酸 硫酸
化學式 HCl H2SO4
顏色、狀態 “純凈”:______液體;工業用鹽酸:_________ ______粘稠、油狀液體
氣味 有刺激性氣味 無
特性 易揮發 不易揮發
用途 ①金屬除銹;②胃液含有少量鹽酸、助消化 ①金屬除銹;②化肥農藥;③精煉石油
無色
黃色(含Fe3+)
無色
3.酸的共性
(1)能使紫色石蕊試液變紅,不能使無色酚酞試液變色。
(2)酸+堿→鹽+水(酸堿反應)
NaOH+HCl===________________
Cu(OH)2+H2SO4===______________
(3)酸+金屬氧化物→鹽+水
Fe2O3+3H2SO4===__________________
CuO+2HCl===______________
NaCl+H2O
CuSO4+2H2O
Fe2(SO4)3+3H2O
CuCl2+H2O
(4)酸+金屬→鹽+氫氣
Mg+2HCl===_____________
Fe+H2SO4===_____________
(5)酸+鹽→新鹽+新酸
HCl+AgNO3===______________
H2SO4+BaCl2===_______________
4.酸具有相似性質的原因是其在水溶液中電離出的陽離子全部是_____。
MgCl2+H2↑
FeSO4+H2↑
AgCl↓+HNO3
BaSO4↓+2HCl
H+
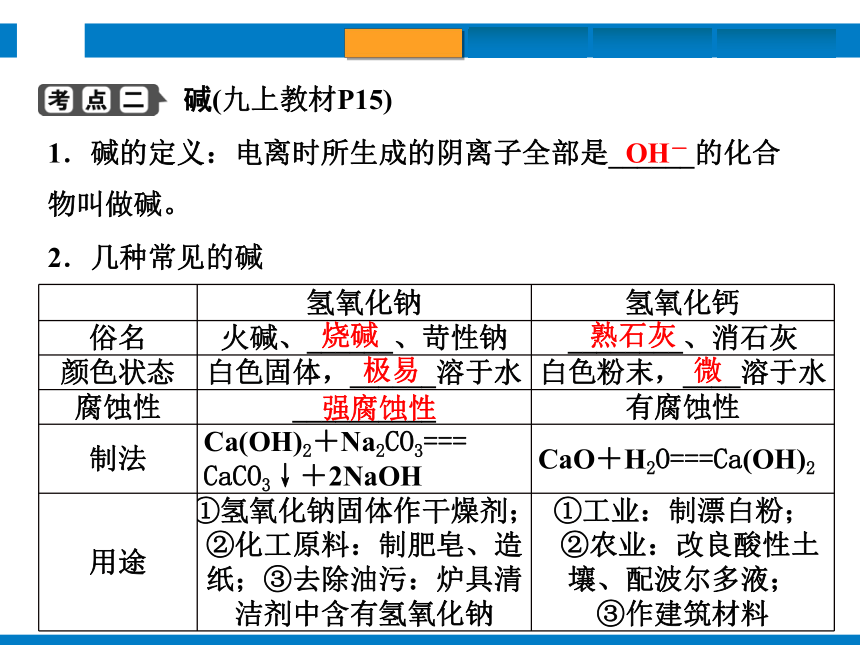
堿(九上教材P15)
1.堿的定義:電離時所生成的陰離子全部是______的化合物叫做堿。
2.幾種常見的堿
OH-
氫氧化鈉 氫氧化鈣
俗名 火堿、______、苛性鈉 ________、消石灰
顏色狀態 白色固體,______溶于水 白色粉末,____溶于水
腐蝕性 __________ 有腐蝕性
制法 Ca(OH)2+Na2CO3===
CaCO3↓+2NaOH CaO+H2O===Ca(OH)2
用途 ①氫氧化鈉固體作干燥劑;②化工原料:制肥皂、造紙;③去除油污:爐具清潔劑中含有氫氧化鈉 ①工業:制漂白粉;
②農業:改良酸性土壤、配波爾多液;
③作建筑材料
燒堿
熟石灰
極易
微
強腐蝕性
3.堿的共性
(1)可溶性堿都能使紫色石蕊試液變______,使無色酚酞試液變_____。
(2)堿+非金屬氧化物→鹽+水
2NaOH+SO2===_______________
Ca(OH)2+CO2===______________
應用:工業上常用堿溶液來吸收SO2氣體,澄清石灰水可用來檢驗CO2氣體。
(3)酸+堿→鹽+水(酸堿反應)
藍色
紅色
Na2SO3+H2O
CaCO3↓+H2O
(4)堿+鹽→新堿+新鹽
2NaOH+CuCl2===__________________
現象:產生藍色絮狀沉淀。
3NaOH+FeCl3===__________________
現象:產生紅褐色沉淀。
Ca(OH)2+Na2CO3===____________________
應用:用于實驗室制取少量的氫氧化鈉。
Cu(OH)2↓+2NaCl
Fe(OH)3↓+3NaCl
CaCO3↓+2NaOH
4.堿具有相似性質的原因是其在水溶液中電離出的陰離子全部是______。
5.氫氧化鈉、氫氧化鈣變質的探究(詳見實驗突破)。
6.氫氧化鈉有強烈的________,使用時要十分小心。若不慎將堿液沾到皮膚上,要用較多的水沖洗,再涂上硼酸溶液。
OH-
腐蝕性
酸堿反應(九上教材P19)
1.酸堿反應:____________________________,屬于復分解反應中的一種。如用復方氫氧化鋁片治療胃酸(主要成分是鹽酸)過多;用熟石灰降低土壤的酸性等。
2.酸堿反應的實質:___________________。
酸與堿作用生成鹽和水的反應
OH-+H+===H2O
溶液的酸堿性(九上教材P5)
1.指示劑只能粗略指示溶液的酸堿性(定性指示),而pH則能表示溶液的________。
2.pH——酸堿度的表示方法
(1)范圍:通常在0~14之間。
(2)測定:最簡便的方法是使用pH試紙。用潔凈干燥的玻璃棒蘸取待測液滴在________上,把試紙顯示的顏色與____________對照。
酸堿度
pH試紙
標準比色卡
(3)pH大小與溶液的酸堿性和指示劑的關系
pH 溶液的酸堿性 石蕊試液顏色 酚酞試液顏色
pH=7 中性溶液 紫色 無色
pH<7 酸性溶液,pH越小,溶液的酸性越強 ______ 無色
pH>7 堿性溶液,pH越大,溶液堿性越強 ______ 紅色
紅色
藍色
1.酸和堿的性質與應用
例1 (2023,麗水)在做有關酸的性質實驗中,下列操作規范的是
( )
A.滴加鹽酸 B.稀釋濃硫酸
C.傾倒鹽酸 D.測鹽酸的pH
B
變式1-1 根據圖回答問題。
(1)反應中,數目減少的離子是____________(填符號)。
(2)驗證反應后溶液中稀鹽酸有剩余,下列操作可行的是______。
A.取樣,加入CuO粉末
B.取樣,滴加NaOH溶液
C.取樣,加入CaCO3粉末
D.取樣,滴加AgNO3溶液
H+、OH-
ABC
變式1-2 為了探究酸堿反應是否放熱,某同學設計了如圖所示的實驗裝置(夾持等固定裝置圖略),針對該實驗目的,下列評價或改進,錯誤的是( )
A.若觀察到紅墨水向右移,則說明該
實驗一定有放熱現象
B.為了使實驗現象更明顯,可改用氫
氧化鈉固體
C.在打開活塞a之前應先打開橡皮管上的止水夾
D.為了使實驗更具有說服力,可用氫氧化鉀溶液再次實驗
B
2.酸堿反應圖像問題
例2 小金同學取了適量實驗室制二氧化碳發生裝置中的剩余溶液。逐滴滴加純堿溶液,繪制產生沉淀的圖像如甲圖所示。
(1)B點對應溶液的溶質是________________(寫化學式)。
(2)乙圖是甲圖中O點到A點的反應微觀實質模型圖。則“ ”表示______(寫化學符號)。
CaCl2、NaCl
Na+
變式2 (2022,紹興)在做酸堿反應的實驗時,向盛有氫氧化鈉溶液的燒杯中,逐漸加入稀鹽酸。燒杯內相關物質的質量與加入稀鹽酸質量的變化關系不正確的是( )
D
溶液的酸堿性及pH
1.(2023,金華)在以下探究氫氧化鈣溶液性質的實驗中,還需借助酸堿指示劑證明化學反應發生的是( )
A B
C D
C
常見酸的性質及用途
2.(2021,臺州)鹽酸在生產和生活中的用途很廣,能與多種物質發生反應。下列物質與鹽酸反應時,能觀察到白色沉淀的是( )
C
3.(2022,溫州)物質的結構決定性質,性質決定用途。下列物質的結構、性質和用途之間匹配正確的是( )
D
選項 結構 性質 用途
A 稀鹽酸中含有氫離子 具有酸性 檢驗溶液中是否含有銀離子
B 稀鹽酸中含有氯離子 具有酸性 檢驗溶液中是否含有銀離子
C 氫氧化鈉溶液中含有鈉離子 具有堿性 吸收二氧化硫氣體
D 氫氧化鈉溶液中含有氫氧根離子 具有堿性 吸收二氧化硫氣體
4.(2023,舟山)小舟要用鋅粒和稀硫酸在實驗室制取一瓶干燥的氫氣。
【實驗原理】Zn+H2SO4===ZnSO4+H2↑。
【發生裝置】根據反應條件與反應物狀態,小舟應選擇的發生裝置是______(選填“甲”或“乙”)。
【收集裝置】為了得到干燥的氫氣,小舟設計了如圖丙的裝置,裝置中液體a可以是__________。
乙
濃硫酸
5.(2023,臺州)濃鹽酸具有揮發性,敞口放置于空氣中,溶質質量分數變小。稀鹽酸會發生同樣的變化嗎?某同學通過如下步驟進行探究。
①取兩個燒杯,各倒入40毫升3%的稀鹽酸,分別標為甲和乙。
②甲密封,液體體積不變。乙敞口放置于空氣中至液體體積變為20毫升。(溶液密度變化忽略不計)
③向甲、乙中滴加幾滴石蕊試液,再分別緩慢滴加相同溶質質量分數的氫氧化鈉溶液,恰好完全反應時,消耗的氫氧化鈉溶液體積分別為30毫升、26毫升。
(1)實驗中,“恰好完全反應”的判斷依據是:溶液顏色_______
____________________。
(2)乙燒杯中的稀鹽酸敞口放置后,溶質質量分數變大,依據是__________________________________________________________________________。
(3)為了確定稀鹽酸敞口放置于空氣中,溶質質量分數一定會變大,請簡要闡述應補充的實驗。
____________________________________________________。
恰好由
紅色變成紫色
稀鹽酸的體積變成一半,所消耗的氫氧化鈉溶液體積大于一半
(合理即可)
換用不同質量分數的稀鹽酸多次重復實驗
常見堿的性質及用途
6.(2022,金華)如圖曲線能正確反映下列化學變化中y與x變化關系的是( )
\
A.鋅粒中滴入稀硫酸:y代表氫氣的質量
B.CaCl2溶液中通入CO2氣體:y代表沉淀的質量
C.氫氧化鈉溶液中滴入稀鹽酸:y代表混合溶液的pH
D.CuSO4和HCl的混合溶液中加入NaOH溶液:y代表沉淀的質量
D
7.(2021,麗水)物質結構決定性質,
物質性質決定用途,反應本質決定變
化現象。如圖是小科構建的氫氧化鈣
部分知識網絡,其中“—”表示相連物質能發生化學反應,X與圖中所給物質的類別不同。請回答:
(1)酚酞試液在Ca(OH)2溶液中顯紅色,能使酚酞試液變紅的離子是______。
(2)列舉熟石灰Ca(OH)2在工農業上的一種用途________________
_____________。
OH-
中和酸性土壤(中和
酸性廢液等)
(3)X溶液能與Ca(OH)2溶液反應并產生藍色絮狀沉淀,寫出產生該實驗現象的一個化學方程式:
______________________________________________________。
CuCl2+Ca(OH)2===Cu(OH)2↓+CaCl2(X是可溶性銅鹽即可)
8.(2023,舟山)小舟在學習“常見的堿”過程中,將新配制的飽和Ca(OH)2溶液滴入到FeCl3溶液中,發現沒有出現預期的紅褐色沉淀。這是為什么呢?小舟查閱資料,獲取如下信息:
①Ca(OH)2微溶于水;②FeCl3溶液呈酸性。于是他提出以下猜想:
猜想一:Ca(OH)2沒有參加化學反應。
猜想二:滴入的Ca(OH)2溶液中OH-數量太少。
猜想三:FeCl3溶液呈酸性,Fe(OH)3沉淀不能存在。
(1)小舟用pH試紙測Ca(OH)2和FeCl3混合液的酸堿度,測得pH<7,說明溶液中沒有OH-。該現象__________(選填“支持”或“不支持”)猜想一。
(2)為增加OH-的數量,換用濃NaOH溶液滴加到FeCl3溶液中(如圖甲),若猜想二正確,則觀察到的現象是_______________。
(3)經過實驗,猜想三驗證成立。然后,小舟將FeCl3溶液逐滴滴加到飽和Ca(OH)2溶液中(如圖乙),先觀察到紅褐色沉淀產生,持續滴加后沉淀又消失了。請你解釋沉淀會消失的原因
_________________________________________________________________________。
不支持
產生紅褐色沉淀
CuCl2+Ca(OH)2===Cu(OH)2↓+CaCl2(X是可溶性銅
鹽即可)
酸堿反應及其應用
9.(2022,嘉舟)判斷物質之間是否發生化學反應需要證據支持。在一定量的氫氧化鈉溶液中加入適量稀鹽酸后,能證明兩者發生化學反應的是( )
A B
C D
A
10.(2021,杭州)取稀鹽酸與氫氧化鈉反應后的溶液進行實驗。下列能說明稀鹽酸、氫氧化鈉恰好都完全反應的是( )
A.加硝酸銀溶液,有白色沉淀生成
B.加氫氧化鎂固體,固體全部溶解
C.加酚酞試液,溶液顯紅色
D.測定溶液的pH,剛好顯中性
D
實驗一、氫氧化鈉變質的探究
1.NaOH變質的原因:
變質的化學反應為_______________________________。
2.怎樣確定NaOH是否變質?
2NaOH+CO2===Na2CO3+H2O
試劑選擇 現象 化學方程式
酸 稀鹽酸 產生氣泡 ____________________________________________
堿 Ca(OH)2溶液 產生白色沉淀 ____________________________________________
鹽 CaCl2溶液 產生白色沉淀 ___________________________________________
Na2CO3+Ca(OH)2===
CaCO3↓+2NaOH
Na2CO3+2HCl===
2NaCl+H2O+CO2↑
Na2CO3+CaCl2===
CaCO3↓+2NaCl
3.怎樣確定NaOH變質的程度?
實驗步驟 實驗分析 現象 結論
(1)取少量樣品溶于水,向其中加入過量的CaCl2溶液(2)再向溶液中滴加酚酞試液
加入過量的CaCl2是檢驗Na2CO3的存在并除去Na2CO3;加酚酞試液是檢驗NaOH的存在
(1)無_______生成
(2)溶液______ 沒有變質
(1)有_________生成
(2)溶液_____ 部分變質
(1)有__________生成
(2)溶液________ 全部變質
沉淀
變紅
白色沉淀
變紅
白色沉淀
不變色
4.保存方法:氫氧化鈉要______保存。
【知識拓展】 用Ca(OH)2溶液雖然能檢驗Na2CO3的存在,但對NaOH的檢驗會產生干擾。
密封
實驗二、氫氧化鈣變質的探究
1.Ca(OH)2變質的原因:變質的化學反應為
__________________________________。
2.怎樣確定Ca(OH)2是否變質?
取少量樣品,向其中滴加足量的________,如有______產生,則證明Ca(OH)2已經變質。
Ca(OH)2+CO2===CaCO3↓+H2O
稀鹽酸
氣泡
3.怎樣確定Ca(OH)2變質的程度?
4.保存方法:氫氧化鈣要______保存。
變紅
實驗步驟 現象 結論
(1)取少量樣品溶于水,向其中滴加無色酚酞試液
(2)加取少量樣品,向其中滴加足量稀鹽酸
(1)溶液______(2)無氣泡產生 沒有變質
(1)溶液______(2)____氣泡產生 部分變質
(1)溶液________(2)____氣泡產生 全部變質
變紅
有
不變色
有
密封
實驗三、稀鹽酸和氫氧化鈉溶液的反應
1.反應原理:__________________________。
2.實驗步驟及現象
(1)在盛有3毫升NaOH稀溶液的試管中加入1毫升酚酞試液,觀察到溶液變紅,再逐滴滴加稀鹽酸,邊滴邊振蕩,直至紅色剛好褪去。
(2)用滴管吸取反應后的溶液滴在蒸發皿中,在酒精燈上烘干,蒸發皿上留下的物質為NaCl。
NaOH+HCl===NaCl+H2O
3.實驗分析和結論
氫氧化鈉稀溶液能使無色酚酞試液變紅色,稀鹽酸和氯化鈉不能使無色酚酞試液變紅,滴加稀鹽酸過程中溶液顏色慢慢變淺,最后變為無色,說明氫氧化鈉與鹽酸發生了反應。
4.酸堿反應的微觀本質
酸溶液中的______和堿溶液中的________結合生成____,微觀反應過程如圖所示。
H+
OH-
水
例 (2023,麗水)實驗室里有兩個試劑瓶,各裝有8克氫氧化鈉固體,久置未用。為檢驗氫氧化鈉變質程度,小科和小麗對瓶中樣品進行了如下探究。
【定性探究】小科取其中一瓶氫氧化鈉樣品進行實驗,實驗過程及現象如圖甲。
甲
(1)圖中藍色絮狀沉淀是____________。
(2)上述探究可得出該瓶氫氧化鈉____________(選填“沒有變質”或“部分變質”)。
【定量實驗】小麗取另一瓶氫氧化鈉樣品進行定量實驗。將瓶中樣品全部倒入燒杯中,加水充分溶解。逐滴加入溶質質量分數為7.3%的稀鹽酸充分反應,當溶液的pH恰好為7時,所加稀鹽酸的質量為100克。
氫氧化銅
部分變質
(3)小麗通過計算得出結論氫氧化鈉完全變質(如圖乙)。小科認為小麗的結論不正確,理由是_________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
由反應的化學方程式NaOH+HCl===NaCl+H2O(即2NaOH+2HCl===2NaCl+2H2O)、2NaOH+CO2===Na2CO3+H2O、Na2CO3+2HCl===2NaCl+H2O+CO2↑可知,氫氧化鈉變質生成碳酸鈉,不論氫氧化鈉變質程度如何,當pH為7時,消耗鹽酸的質量是一樣的,所以用鹽酸的質量來計算是錯誤的
(4)要確定樣品中氫氧化鈉的質量,在小麗的實驗方案中,缺少____________質量的測定。
二氧化碳
展開更多......
收起↑
 資源預覽
資源預覽