資源簡介
資源簡介
(共50張PPT)
必修第二冊
第七章
有機化合物
第一節(jié)
第三課時烷烴的性質(zhì)
1.通過實驗探究甲烷與氯氣的反應(yīng),理解取代反應(yīng)的本質(zhì)。培養(yǎng)科學(xué)探究與創(chuàng)新意識。
2.通過閱讀教材,認識烷烴的物理性質(zhì)和化學(xué)性質(zhì),培養(yǎng)微觀探析與變化觀念等學(xué)科素養(yǎng)。
3.初步了解多數(shù)有機物與無機物的區(qū)別。
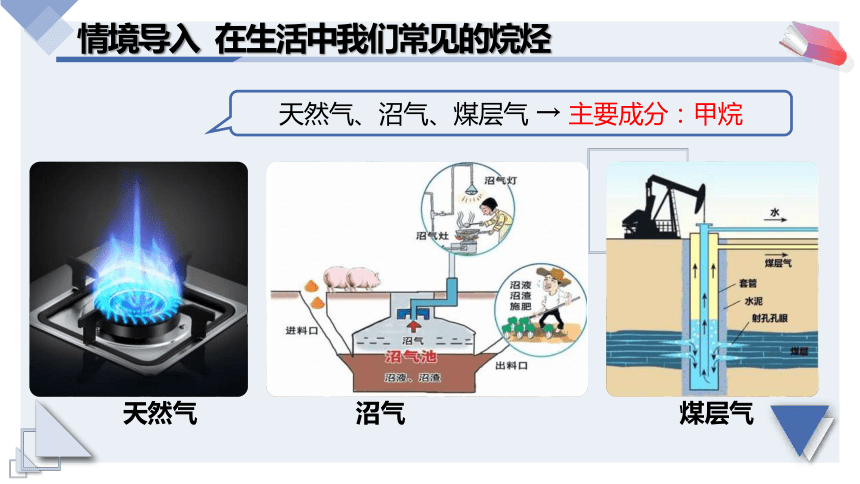
情境導(dǎo)入 在生活中我們常見的烷烴
天然氣、沼氣、煤層氣 → 主要成分:甲烷
煤層氣
天然氣
沼氣
情境導(dǎo)入 在生活中我們常見的烷烴
蠟燭、蠟筆、凡士林 → 主要成分:含碳原子數(shù)較多的烷烴
結(jié)合生活經(jīng)驗以及所學(xué)知識,想想烷烴可能有哪些性質(zhì)?
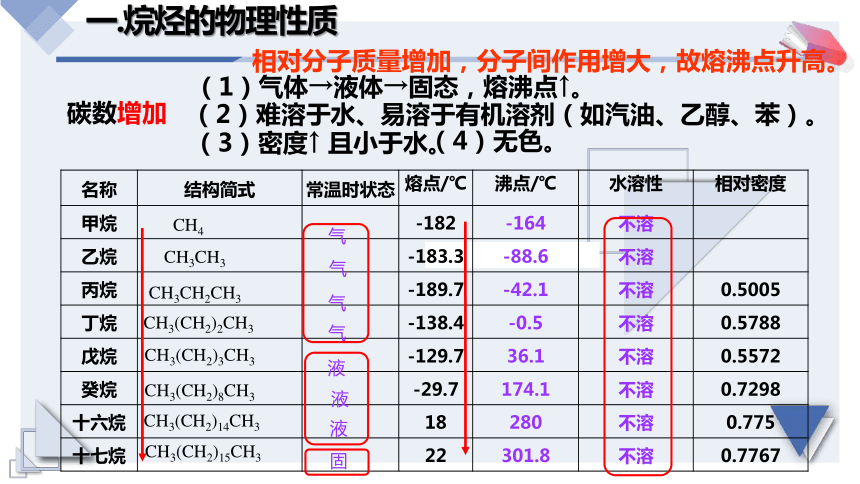
一.烷烴的物理性質(zhì)
名稱 結(jié)構(gòu)簡式 常溫時狀態(tài) 熔點/℃ 沸點/℃ 水溶性 相對密度
甲烷 -182 -164 不溶
乙烷 -183.3 -88.6 不溶
丙烷 -189.7 -42.1 不溶 0.5005
丁烷 -138.4 -0.5 不溶 0.5788
戊烷 -129.7 36.1 不溶 0.5572
癸烷 -29.7 174.1 不溶 0.7298
十六烷 18 280 不溶 0.775
十七烷 22 301.8 不溶 0.7767
CH3CH3
CH3CH2CH3
CH3(CH2)2CH3
CH4
CH3(CH2)8CH3
CH3(CH2)14CH3
CH3(CH2)15CH3
CH3(CH2)3CH3
氣
氣
氣
氣
液
液
液
固
(1)氣體→液體→固態(tài),熔沸點↑。
(3)密度↑ 且小于水。
(2)難溶于水、易溶于有機溶劑(如汽油、乙醇、苯)。
碳數(shù)增加
相對分子質(zhì)量增加,分子間作用增大,故熔沸點升高。
(4)無色。
一般情況下
一.烷烴的物理性質(zhì)
碳原子數(shù) 常溫下
1≤n≤4 氣態(tài)
5≤n≤16 液態(tài)
n>16 固態(tài)
二.烷烴的化學(xué)性質(zhì)
1. 穩(wěn)定性
通常情況下,烷烴比較穩(wěn)定,與強酸、強堿、酸性高錳酸鉀溴的四氯化碳溶液等強氧化劑都不發(fā)生反應(yīng)。
但其穩(wěn)定性是相對的,在特定的條件下,烷烴也會發(fā)生某些反應(yīng)。
二.烷烴的化學(xué)性質(zhì)
煤礦中的爆炸事故多與甲烷氣體爆炸有關(guān)。為了保證安全生產(chǎn),必須采取通風(fēng)、嚴禁煙火等措施。
點燃之前必須驗純!
甲烷的燃燒實驗
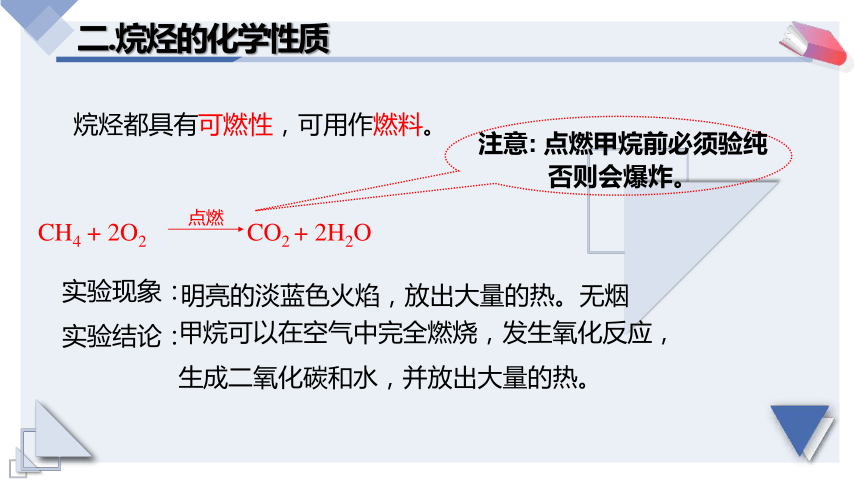
2.氧化反應(yīng)
二.烷烴的化學(xué)性質(zhì)
烷烴都具有可燃性,可用作燃料。
CH4 + 2O2 CO2 + 2H2O
點燃
注意: 點燃甲烷前必須驗純
否則會爆炸。
實驗現(xiàn)象:
實驗結(jié)論:
甲烷可以在空氣中完全燃燒,發(fā)生氧化反應(yīng),
生成二氧化碳和水,并放出大量的熱。
明亮的淡藍色火焰,放出大量的熱。無煙
1.試著寫出丙烷(C3H8)燃燒的方程式?
二.烷烴的化學(xué)性質(zhì)
C3H8 + 5O2 3CO2 + 4H2O
點燃
注意:有機反應(yīng)式通常用箭頭!
2.與甲烷相似,烷烴可以在空氣中完全燃燒,發(fā)生氧化反應(yīng),生成二氧化碳和水,并放出大量的熱。試著寫出烷烴(CnH2n+2)燃燒的方程式?
二.烷烴的化學(xué)性質(zhì)
烷烴燃燒通式為:
CnH2n+2 + O2 n CO2 + (n + 1) H2O
點燃
典型例題
B. 在通常條件下,烷烴和硫酸、氫氧化鈉不反應(yīng),和酸性KMnO4溶液也不反應(yīng)
C. 在做甲烷、乙烷燃燒試驗前,氣體一定要驗純
A. 常溫常壓下,CH4、C2H6和C3H8為氣體,C4H10、C6H14呈液態(tài)
D. 使用天然氣(主要成分為CH4)的燃氣灶,改用液化石油氣(主要成分為C4H10),應(yīng)減小進氣量或增大進風(fēng)量
1. 下列說法錯誤的是( )
A
典型例題
2.某鏈狀烷烴完全燃燒生成17.6g CO2和 9.0g 水,推測其分子式。
n
n+1
理論值
0.4
0.5
實際值
所以 n為4 則烷烴分子式為C4H10
9.0 g
18 g/mol
n(H2O)= =0.5 mol
17.6 g
44 g/mol
n(CO2)= =0.4 mol
比例式:
3.★★★★
120℃時,l體積某烴和4體積O2混合,完全燃燒后,恢復(fù)到原來的溫度和壓強,體積不變,該烴分子中所含碳原子數(shù)不可能是( )
A.1 B.2 C.3 D.4
典型例題
D
二.烷烴的化學(xué)性質(zhì)
3.分解反應(yīng)
烷烴在較高溫度下會發(fā)生分解。
應(yīng)用于石油化工和天然氣化工生產(chǎn)從烷烴
→ 化工基本原料和燃料
C18H38 C10H22 + C8H16
十八烷
癸烷
催化劑
加熱、加壓
【實驗7-1】
取兩支試管,均通過排飽和NaCl溶液的方法收集半試管CH4,和半試管Cl2,分別用鐵架臺固定好(如圖7-8)。將其中一支試管用鋁箔套上,另一支試管放在光亮處(不要放在日光直射的地方)。靜置,比較兩支試管內(nèi)的現(xiàn)象。
實驗探究——甲烷與氯氣反應(yīng)
甲烷和氯氣的取代反應(yīng)
實驗現(xiàn)象 實驗結(jié)論
套上鋁箔的試管無明顯現(xiàn)象 無光條件不反應(yīng)
光亮處的試管氣體顏色(黃綠色)逐漸變淺 甲烷能與Cl2發(fā)生反應(yīng)
試管壁出現(xiàn)油狀液滴 生成難溶于水的物質(zhì)
同時出現(xiàn)少量白霧 反應(yīng)中生成了氯化氫氣體
試管內(nèi)液面上升 氣體體積減小,氣體溶于水中使試管內(nèi)壓強減小
飽和食鹽水中有少量 固體析出 Cl-飽和
甲烷和氯氣的取代反應(yīng)
CH4
Cl2
CH3Cl
C
H
Cl
HCl
一氯甲烷
劇毒氣態(tài)(g)、難溶于水
甲烷和氯氣的取代反應(yīng)
CH3Cl
CH2Cl2
Cl2
C
H
Cl
有毒液態(tài)(l)、難溶于水
二氯甲烷
甲烷和氯氣的取代反應(yīng)
C
H
Cl
★用途:可作麻醉劑
甲烷和氯氣的取代反應(yīng)
C
H
Cl
★用途:可用于滅火
4.取代反應(yīng):
有機物分子里的某些原子或原子團被其他原子或原子團所替代的反應(yīng)。
甲烷和氯氣的取代反應(yīng)
氯乙烯、四氯化碳、氯仿等對肝臟有很強的毒性,有些有致癌性。
有些有機氯化合物在環(huán)境中非常穩(wěn)定,如多氯聯(lián)苯(PCD)、DDT和六六六等,自停止生產(chǎn)至今,在水體、底泥和生物體中仍可檢測出較高的殘留物。
由于有脂溶性,在生物體內(nèi)代謝緩慢,通過食物鏈濃縮、累積,主要是造成長期慢性毒性效應(yīng)。
了解有機氯化物的毒性
環(huán)境中有機氯化合物的另一類來源是飲用水的氯氣消毒作用。
已證實會形成氯仿、二氯乙烷、一溴二氯甲烷、二溴一氯甲烷等。
美國要求城市飲用水對四氯化碳和1,2-二氯乙烷進行檢測。
了解有機氯化物的毒性
將裝有甲烷和氯氣混合氣體的三個集氣瓶,用玻璃片把瓶口蓋好后,分別作如下處理,各有怎樣的現(xiàn)象發(fā)生
(1)置于黑暗處 。
(2)將點燃的鎂條靠近集氣瓶外壁 。
(3)放在光亮的教室里 。
(4)甲烷和氯氣發(fā)生的一系列反應(yīng)都是 反應(yīng)(填反應(yīng)類型),生成的有機物中常用作有機溶劑的是 ,
可用作滅火劑的是 。
無明顯現(xiàn)象
發(fā)生爆炸
黃綠色逐漸變淺,最后消失,瓶壁上出現(xiàn)油狀液滴
取代
CHCl3、CCl4
CCl4
1.甲烷與氯氣發(fā)生反應(yīng)時,所得產(chǎn)物有幾種 ?
2.能否用CH4和Cl2按1∶1的體積比混合來制取純凈的CH3Cl
積極思考
用CH4和Cl2按1∶1的體積比混合不能制取純凈的CH3Cl。
CH4和Cl2的反應(yīng)是連鎖反應(yīng),不可能只發(fā)生第一步取代反應(yīng)。
生成物為混合物。
反應(yīng)中得到CH3Cl、CH2Cl2、CHCl3、CCl4四種有機物和HCl,
共5種產(chǎn)物。
3.CH4和Cl2發(fā)生取代反應(yīng)時,每有1 mol氫原子被取代,消耗的Cl2分子的物質(zhì)的量是多少?生成的HCl分子的物質(zhì)的量分別是多少?
積極思考
每有1 mol氫原子被取代,消耗1 mol Cl2分子,同時生成1 mol HCl分子。
反應(yīng)物
反應(yīng) 條件
生成物
反應(yīng) 特點
甲烷與氯氣(不能用氯水,需純鹵素單質(zhì))
漫散光照射(不用太陽光直射,以防爆炸)
甲烷與氯氣反應(yīng)生成四種有機產(chǎn)物:CH3Cl、CH2Cl2、CHCl3、CCl4和無機物HCl,其中HCl的產(chǎn)量最多(產(chǎn)物復(fù)雜)
連鎖反應(yīng)
甲烷中的氫原子被氯原子逐步取代,各步反應(yīng)同時進行,即第一步反應(yīng)一旦開始,后續(xù)反應(yīng)立即進行
數(shù)量關(guān)系
每取代1 mol氫原子,消耗1 mol Cl2,生成1 mol HCl
甲烷和氯氣的取代反應(yīng)
一上一下,
有進有出
類似無機反應(yīng)中的復(fù)分解反應(yīng),注意在書寫化學(xué)方程式時,防止漏寫產(chǎn)物中的小分子。
1.判斷正誤(正確的打“√”,錯誤的打“×”)
(1) C3H8的熔、沸點和密度均比C6H14的低。 ( )
(2) 烷烴在光照下均能與Cl2發(fā)生取代反應(yīng)。 ( )
(3) CH4、C2H6均能使酸性KMnO4溶液褪色。 ( )
(4) 烷烴很穩(wěn)定,不能發(fā)生分解反應(yīng)。 ( )
(5) 點燃混有空氣的甲烷不一定會爆炸。 ( )
(6) 點燃甲烷前不需要驗純。 ( )
√
√
√
×
×
×
2.在一定條件下,能與甲烷發(fā)生反應(yīng)的是( )
A.濃硫酸
B.氫氧化鈉溶液
C.溴蒸汽
D.高錳酸鉀溶液
C
3.下列應(yīng)屬于取代反應(yīng)的是( )
D
4.二氟甲烷是性能優(yōu)異的環(huán)保產(chǎn)品,它可替代某些會破壞臭氧層的“氟里昂”產(chǎn)品,用作空調(diào)、冰箱和冷凍庫的制冷劑。試判斷二氟甲烷的結(jié)構(gòu)簡式有( )
A. 4種 B. 3種 C. 2種 D. 1種
D
5.在下列反應(yīng)中,光照對反應(yīng)幾乎沒有影響的是 ( )
A. 氯氣與氫氣反應(yīng)
B. 氯氣與甲烷反應(yīng)
C. 次氯酸分解
D. 甲烷與氧氣反應(yīng)
D
6.室溫下,下列關(guān)于甲烷與Cl2的取代反應(yīng)所得產(chǎn)物的說法正確的是( )
A.都是有機物
B.都不溶于水
C.有一種氣態(tài)物質(zhì),其余均是液體
D.除一種外,其余分子均是四面體結(jié)構(gòu)
D
典型例題
1. 實驗室中用如圖所示的裝置進行甲烷與氯氣在光照下反應(yīng)的實驗。光照下反應(yīng)一段時間后,下列裝置示意圖中能正確反映實驗現(xiàn)象的是( )
D
典型例題
2. 有機物分子里的原子(或原子團)被其他原子(或原子團)所替代的反應(yīng)叫做取代反應(yīng),下列反應(yīng)中屬于取代反應(yīng)的是( )
A. AgNO3 + HCl = AgCl↓ + HNO3
B. CH4 + 2O2 → CO2 +2H2O
C. CH2Br2 + Cl2 → CHClBr2 + HCl
D. CH3CH2OH → CH2=CH2↑ + H2O
點燃
濃硫酸
170℃
光
C
典型例題
3.在常溫、常壓下,取下列四種氣態(tài)烴各1 mol , 分別在足量的氧氣中燃燒 消耗氧氣最多的是 ( )
A.CH4 B.C3H8 C.C4H10 D.C2H6
C
4.下列物質(zhì)在一定條件下可與乙烷發(fā)生化學(xué)反應(yīng)的是( )
A.氯氣 B.溴水 C.氯水 D.酸性高錳酸鉀溶液
A
1.上圖說明甲烷是可燃性氣體,在點燃可燃性氣體前要注意什么
2.根據(jù)甲烷的性質(zhì),推測丙烷的化學(xué)性質(zhì)有哪些
3.多碳原子烷烴(如CH3—CH2—CH2—CH3)分子中,碳鏈是直線狀嗎
積極思考
可燃性氣體在點燃前要驗純,因為可燃性氣體和空氣混合,如果在爆炸極限內(nèi),點燃會發(fā)生爆炸。
能與O2發(fā)生燃燒反應(yīng),能與Cl2在光照下發(fā)生取代反應(yīng)。
不是。
在CH3—CH2—CH2—CH3分子中,碳原子與其相連的4個原子在空間形成四面體結(jié)構(gòu),因此多碳原子烷烴分子中的碳鏈應(yīng)為鋸齒狀。
典型例題
5.★★★★
在標準狀況下,22.4 L CH4與Cl2在光照下發(fā)生取代反應(yīng),待反應(yīng)完全后,測得四種有機取代物的物質(zhì)的量相等,則消耗的Cl2的物質(zhì)的量為( )
A.0.5 mol
B.2 mol
C.2.5 mol
D.4 mol
C
1 mol CH4與Cl2發(fā)生取代反應(yīng),
生成CH3Cl、CH2Cl2、CHCl3、CCl4各0.25 mol,
這四種取代物中n(Cl)=0.25 mol×(1+2+3+4)=2.5 mol,
根據(jù)取代反應(yīng)特點,生成的n(HCl)=2.5 mol
,故生成物中所含氯原子共2.5 mol+2.5 mol=5 mol,
參加反應(yīng)的Cl2的物質(zhì)的量n(Cl2)=2.5 mol。
典型例題
5-1.
如果使0.5 mol甲烷完全跟Cl2發(fā)生取代反應(yīng)并生成等物質(zhì)的量的四種氯代物,則需要消耗氯氣( )
A.0.5 mol B.1 mol C.1.5 mol D.1.25 mol
D
氯代物的物質(zhì)的量為 0.5/4=0.125mol
所需氯氣的物質(zhì)的量為:
0.125×1+0.125×2 + 0.125×3+0.125×4=1.25mol
5-2
下列有關(guān)甲烷的取代反應(yīng)的敘述正確的是 ( )
A.甲烷與氯氣的物質(zhì)的量之比為1∶1時,混合發(fā)生取代反應(yīng)只生成CH3Cl
B.甲烷與氯氣的取代反應(yīng),生成的產(chǎn)物中CH3Cl的物質(zhì)的量最多
C.甲烷與氯氣的取代反應(yīng)生成的產(chǎn)物為混合物
D.1 mol甲烷生成CCl4最多消耗2 mol氯氣
C
典型例題
6. 某課外活動小組利用如圖所示裝置探究甲烷與氯氣的反應(yīng)。根據(jù)題意,回答下列問題。
(1)CH4與Cl2發(fā)生反應(yīng)的條件是 ;若用日光直射,可能會引起 。
光照(或光亮處)
爆炸
(2)實驗中可觀察的實驗現(xiàn)象有:量筒內(nèi)壁出現(xiàn)
油狀液滴,飽和食鹽水中有少量固體析出, _______ , ________________等。
量筒內(nèi)黃綠色氣體顏色變淺
量筒內(nèi)液面上升
(3)實驗中生成的油狀液滴的化學(xué)式為 _______,其中 ______ 是工業(yè)上重要的溶劑。
(4)用飽和食鹽水而不用水的原因是 ___ __________、______________________________。
CH2Cl2、CHCl3、CCl4
CHCl3、CCl4
降低Cl2在水中的溶解度
抑制Cl2和水的反應(yīng)
1.烷烴的結(jié)構(gòu)特點
(1)單鍵:碳原子之間以碳碳單鍵相結(jié)合。
(2)飽和:碳原子剩余價鍵全部與氫原子相結(jié)合,烷烴是飽和烴。
2.烷烴的化學(xué)性質(zhì)
烷烴的化學(xué)性質(zhì)和甲烷相似,通常情況下不與強酸、強堿以及強氧化劑發(fā)生反應(yīng),都不能夠使酸性高錳酸鉀溶液以及溴水褪色。
(1)鏈狀烷烴在光照條件下與鹵素單質(zhì)發(fā)生取代反應(yīng)。
烷烴
1.寫出乙烷與氯氣反應(yīng)生成一氯代物的化學(xué)方程式
2.寫出丙烷與氯氣反應(yīng)生成一氯代物的化學(xué)方程式
積極思考
對稱
對稱
1.
下列有關(guān)烷烴的敘述中,正確的是( )
①在烷烴分子中,所有的化學(xué)鍵都是單鍵
②烷烴中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
③通式為CnH2n+2的烴不一定是烷烴
④所有的烷烴在光照條件下都能與氯氣發(fā)生取代反應(yīng)
⑤光照條件下,乙烷通入溴水中,可使溴水褪色
A.①③⑤ B.②③ C.①④ D.①②④
C
2.下列性質(zhì)中,屬于烷烴特征的是( )
A.完全燃燒只生成二氧化碳和水
B.不溶于水
C.分子的通式為CnH2n+2,與氯氣在光照條件下發(fā)生取代反應(yīng)
D.密度都較小
C
3.(雙選)關(guān)于烷烴的敘述不正確的是( )
A.分子式符合CnH2n+2的烴一定是烷烴
B.烷烴均能與氯水發(fā)生取代反應(yīng)
C.正戊烷的熔點、沸點比異戊烷的高
D.烷烴能被酸性高錳酸鉀溶液等強氧化劑氧化
BD
總結(jié)
烷烴的性質(zhì)
物理性質(zhì):碳原子數(shù)遞增,熔沸點、密度遞增,
狀態(tài):氣→液→固
化學(xué)性質(zhì):
(1)穩(wěn)定性:與強酸、強堿或高錳酸鉀等強氧化劑不反應(yīng)
(4)取代反應(yīng):與鹵素單質(zhì)光照取代
(2)氧化反應(yīng):燃燒
(3)高溫分解
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽