資源簡介
資源簡介
(共29張PPT)
第三章 水溶液中的離子反應與平衡
第一節 電離平衡
第二課時 電離平衡常數
課前導入
蚊蟲叮咬人時,常向人體血液中注入一種含有蟻酸(即甲酸,HCOOH)的液體。
從電離平衡的角度分析皮膚被螞蟻、毛蟲叮咬后出現紅胂的原因。
已知人體血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
影響電離平衡的因素
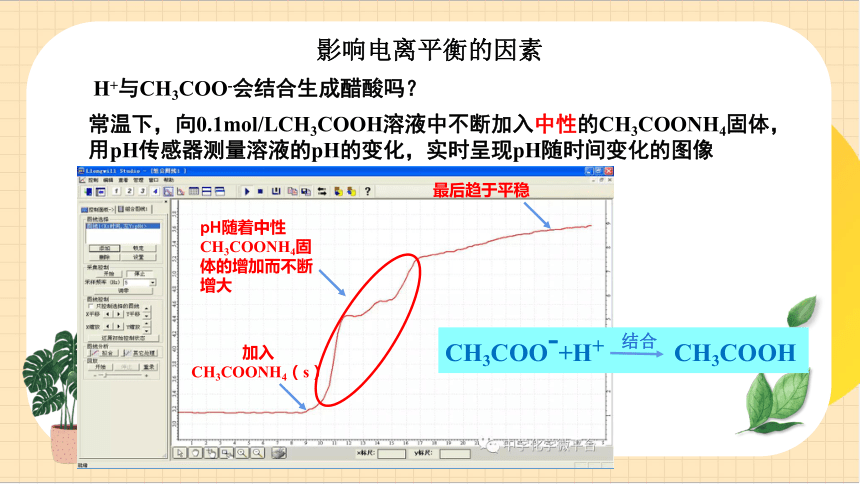
H+與CH3COO-會結合生成醋酸嗎?
常溫下,向0.1mol/LCH3COOH溶液中不斷加入中性的CH3COONH4固體,用pH傳感器測量溶液的pH的變化,實時呈現pH隨時間變化的圖像
加入CH3COONH4(s)
pH隨著中性CH3COONH4固體的增加而不斷增大
最后趨于平穩
CH3COO-+H+ CH3COOH
結合
影響電離平衡的因素
回顧一下
影響化學平衡的因素有哪些
平衡移動方向有什么規律呢
水溶液中的離子反應是化學反應中一種常見的、典型的反應體系。故化學平衡的一般原理同樣適用于弱電解質的電離平衡
平衡移動遵循勒夏特列原理:改變影響化學平衡的一個因素,平衡將向能減弱這種改變的方向移動。
因素:溫度、濃度、壓強
影響電離平衡的因素
類比分析:
影響弱電解質電離平衡的因素有哪些
電離平衡移動方向又有什么規律呢
同樣的,電離平衡移動也遵循勒夏特列原理
影響因素 平衡移動方向
溫度
濃度
影響因素:溫度、濃度、壓強
升溫電離平衡向吸熱方向移動
增大某粒子濃度電離平衡向該粒子濃度減小的方向移動
×
影響電離平衡的因素
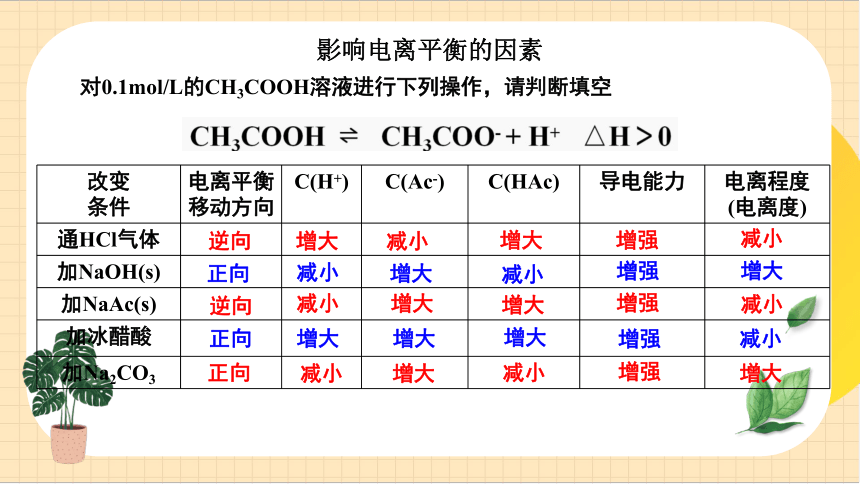
改變 條件 電離平衡移動方向 C(H+) C(Ac-) C(HAc) 導電能力 電離程度
(電離度)
通HCl氣體
加NaOH(s)
加NaAc(s)
加冰醋酸
加Na2CO3
逆向
增大
減小
正向
減小
增大
減小
逆向
減小
增大
增大
增大
減小
增大
減小
增大
增大
減小
正向
增大
對0.1mol/L的CH3COOH溶液進行下列操作,請判斷填空
正向
減小
減小
增強
增大
增大
增強
增強
增強
增強
影響電離平衡的因素
通常電解質越弱電離程度越小。
內因:
①溫度
②濃度
③其他因素
外因:
電離平衡是動態平衡,遵循勒夏特列原理
特別說明:電離程度相當于化學反應中反應物的轉化率
已電離弱電解質分子數
原弱電解質分子數
×100%
電離度 =
已電離的溶質濃度
溶質的初始濃度
= ————————×100%
影響電離平衡的因素
①加水稀釋:平衡向右移動,電離程度增大。(越稀越電離)
②增大弱電解質濃度:平衡向右移動,電離程度減小;(越稀越電離)
③同離子效應:在弱電解質溶液中加入同弱電解質具有相同離子的
強電解質,使電離平衡逆向移動。(同粒抑電離)
④化學反應:在弱電解質溶液中加入能與弱電解質電離出的某種離子
反應的物質時,使電離平衡正向移動。(反應促電離)
(1)濃度的影響:
影響電離平衡的因素
【結論】由于電離過程吸熱,升高溫度,電離平衡向電離的方向移動,電離程度增大; 降低溫度,電離平衡逆向移動,電離程度減小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎樣變化?
增大
△H>0
“越熱越電離”
【特別注意】易揮發或易分解的弱電解質的電離平衡,溫度過高,使分子濃度減小,平衡向逆向移動。
(2)溫度的影響:
影響電離平衡的因素
CO2、H2CO3?
思考:小孩大哭過后,容易出現抽抽搭搭,停不下來、喘不上氣,或者手腳僵硬的情況。
已知人體血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
人體血液的pH需維持在7.35~7.45。
當pH<7.35會導致酸中毒,pH大于7.45會導致堿中毒。
小孩大哭后出現的生理癥狀,與上述平衡相關,是隨著哭泣,呼出大量CO2,平衡狀態改變后,發生了輕微堿中毒。
影響電離平衡的因素
分析問題的化學本質
直接吸入大量CO2合理嗎?
需要控制條件,使上述平衡正向移動
【思考】出現輕微堿中毒后,如何緩解中毒癥狀呢?
可用紙袋,罩于鼻、口上再呼吸,增加動脈血CO2濃度
嚴重時需及時就醫
會窒息
H2O + CO2 H2CO3 H+ + HCO3-
電離平衡常數
定義:對一元弱酸或者一元弱堿來說,在一定條件下,弱電解質的電離達到平衡時,溶液中弱電解質電離所生成的各種離子濃度的乘積,與溶液中未電離分子的濃度之比是個常數,這個常數稱為電離平衡常數,簡稱電離常數。
弱酸、弱堿的電離常數通常分別用Ka、 Kb表示。
一、電離平衡常數的概念與表達式
電離平衡常數
一、電離平衡常數的概念與表達式
多元弱酸的電離是分步進行的,所以酸的元數是多少,就有幾個電離常數。多元弱酸電離常數依次稱為Ka1、Ka2……
例1:H2CO3是二元弱酸,其電離方程式和電離常數分別為:
=4.5×10-7
c(H+)·c(HCO3-)
c(H2CO3)
Ka1=
H2CO3 H++HCO3-
=4.7×10-11
c(H+)·c(CO32-)
c(HCO3-)
Ka2=
HCO3- H++CO32-
Ka1 Ka2,因此計算多元弱酸溶液的c(H+)時,通常只考慮第一步電離。
電離平衡常數
二、電離平衡常數的意義
結論:一定溫度下,K值越大,弱電解質的電離程度越大,酸性(或堿性)越強。
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>HCO3->HS
電離平衡常數表示弱電解質的電離能力。
1
2
3
4
5
電離平衡常數
三、電離平衡常數的影響因素
【思考】對比如下數據,電離平衡常數受哪些因素的影響?
表1:25℃ 幾種弱酸的 Ka
表2:不同溫度下CH3COOH的 Ka
溫度 Ka
0℃ 1.66×10-5
10℃ 1.73×10-5
25℃ 1.75×10-5
弱電解質 Ka
HF 6.3×10-4
CH3COOH 1.75×10-5
HCN 6.2×10-10
相同溫度下,Ka 越大,弱酸越易電離,電離程度越大,酸性越強。
(2)外因:溫度;升高溫度,電離常數 K 增大。
(1)內因:弱酸的自身性質決定。
電離平衡常數
實驗現象:醋酸與Na2CO3溶液混合放出無色無味氣體
實驗;向盛有0.1 mol/L醋酸溶液中滴加等濃度Na2CO3溶液,觀察現象。
醋酸 碳酸
K a 1.75×10-5 4.45×10-7(Ka1)
4.7×10-11(Ka2)
推斷:酸性:醋酸>碳酸
觀察Ka:醋酸>碳酸
得出結論:在相同溫度下,電離常數越大,表示該弱電解質越易電離,酸(堿)性越強
【思考】電離常數的大小與弱電解質本身的強弱有何關系呢?
電離平衡常數
判斷復分解反應能否發生,以及確定產物
酸性:HCOOH > HCN
HCOOH+NaCN===HCN+HCOONa
【例題】 已知:Ka(HCOOH)=1.77×10-4 mol·L-1
Ka(HCN)=4.9×10-10 mol·L-1
HCOONa 與 HCN不反應
問下列反應是否能發生,若能發生請寫出化學方程式:
(1)HCOOH與NaCN溶液:
(2)HCOONa 與 HCN溶液:
強酸制弱酸——弱酸與鹽溶液的反應規律
四、電離平衡常數的應用
電離平衡常數
比較溶液中離子濃度的大小
【例題】已知:磷酸存在的三步電離,這三步的電離常數大小進行比較,
第一步K1 > 第二步K2 > 第三步K3
C(H+) c(H2PO4-) c(HPO42-) c(PO43- ) c(OH-)
離子濃度:
>
>
>
>
電離平衡常數
一般弱酸的電離常數越小,酸性越弱,弱酸根離子結合氫離子的能力就越強。
酸性 :
CH3COOH>H2CO3>
CH3COO- _____ HCO3- _____ CO32-
<
<
結合H+能力:
判斷離子結合質子的能力
【例】CH3COOH溶液加水稀釋,
c(H+)減小,Ka不變,則 增大。
判斷濃度比
電離平衡常數
五、電離平衡常數的計算
【例】在某溫度時,溶質的物質的量濃度為0.2mol·L-1的氨水中,達到電離平衡時,已電離的NH3·H2O為1.7×10-3 mol·L-1,試計算該溫度下NH3·H2O的電離常數(Kb)。
NH3·H2O NH4+ + OH-
起始濃度
變化濃度
平衡濃度
0.2
0
0
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
0.2-1.7×10-3
c(NH3·H2O)
=(0.2-1.7×10-3)mol·L-1
≈0.2mol·L-1
Kb=
c(NH4+)·c(OH-)
c(NH3·H2O)
=
(1.7×10-3)·(1.7×10-3)
0.2
≈1.4×10-5
(1)K值的計算
電離平衡常數
(2)利用平衡常數求離子濃度
=
x·x
0.2
≈
1.75×10 5
變化濃度/(mol·L 1)
x
x
x
平衡濃度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.00187 mol/L
【例】已知25 ℃時,CH3COOH的Ka=1.75×10 5,計算0.2mol·L 1的CH3COOH達到電離平衡時c(H+)的濃度。
0
起始濃度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
電離平衡常數
(3)電離度的計算
【例】在某溫度,溶質的物質的量濃度為 0.2 mol·L 1的氨水中,達到電離平衡時,已電離的NH3·H2O為1.7×10 3 mol·L 1,試計算NH3·H2O的電離度?
電離度:實際上是一種平衡轉化率,表示弱電解質在水中的電離程度。
電離度=
1.7×10 3×V(溶液)
0.2×V(溶液)
×100%
=
0.85%
已電離弱電解質分子數
原弱電解質分子數
×100%
電離度 =
已電離的溶質濃度
溶質的初始濃度
= ————————×100%
電離平衡常數
HCOOH CH3COOH H2CO3
HCO3-
K a(25℃) 1.8×10-4 1.75×10-5 4.5×10-7 4.7×10-11
【思考】現在同學們知道課前提出的2個有關蟻酸的問題的答案了么
①如何比較相同溫度、相同濃度甲酸與醋酸、碳酸的酸性強弱?
查閱課本 附錄Ⅱ
比較酸性強弱看K a 大小、K a 越大酸性越強
Na2CO3+2HCOOH=2HCOONa+H2O+CO2↑
②被蚊子叮咬后 涂抹蘇打水發生了什么化學反應呢?
由于K a:HCOOH>H2CO3
總結歸納
弱電解質的電離
影響電離平衡的因素
電離平衡常數
外因(溫度、濃度)
表達式
影響因素
應用
意義
計算
內因
隨堂訓練
1、下列關于電離常數的說法正確的是( )
A.電離常數隨著弱電解質濃度的增大而增大
B.CH3COOH的電離常數表達式為Ka=CH3COO-(CH3COOH)
C. 向CH3COOH溶液中加入少量CH3COONa固體,電離常數減小D.電離常數只與溫度有關,與弱電解質濃度無關
D
隨堂訓練
2.下表是常溫下某些一元弱酸的電離常數:
則0.1 mol/L的下列溶液中,c(H+)最大的是( )
A.HCN B.HF
C.CH3COOH D.HNO2
弱酸 HCN HF CH3COOH HNO2
電離常數 6.2×10-10 6.8×10-4 1.8×10-5 6.4×10-6
B
隨堂訓練
3.在氨水中存在下列電離平衡:NH3·H2O NH4++OH-,下列情況能引起電離平衡向正向移動的有( )
①加NH4Cl固體 ②加NaOH溶液 ③通HCl
④加CH3COOH溶液 ⑤加水 ⑥加壓
A.①③⑤ B.①④⑥ C.③④⑤ D.①②④
C
隨堂訓練
4、在一定溫度下,冰醋酸加水溶解并不斷稀釋過程中,溶液導電能力與加
入水的體積有如下變化關系:試回答:
⑴ “0”點導電能力為0的理由是: 。
⑵ a、b、c三點對應溶液的pH值由大到小的順序是: 。
⑶ a、b、c三點中電離程度最大的是 。
電離平衡常數的關系 。
⑷若使c點溶液中c(Ac-)、PH值均增大,可采取的措施
有: 。
冰醋酸中只存在醋酸分子,無離子
a﹥c﹥b
C
相等
①加堿②加碳酸鈉③加鎂或鋅
非常感謝您的觀看
展開更多......
收起↑
 資源預覽
資源預覽