資源簡介
資源簡介
(共25張PPT)
《第二章 分子結構與性質—共價鍵極性》
2022級高二·選擇性必修2
共價鍵
極性共價鍵
非極性共價鍵
由不同原子形成的共價鍵,
電子對會發生偏移
由相同原子形成的共價鍵,電子對不發生偏移
H—Cl
δ+
δ-
氯化氫分子中的極性共價鍵
【任務一:鍵的極性】
Cl
Cl
氯氣分子中的非極性共價鍵
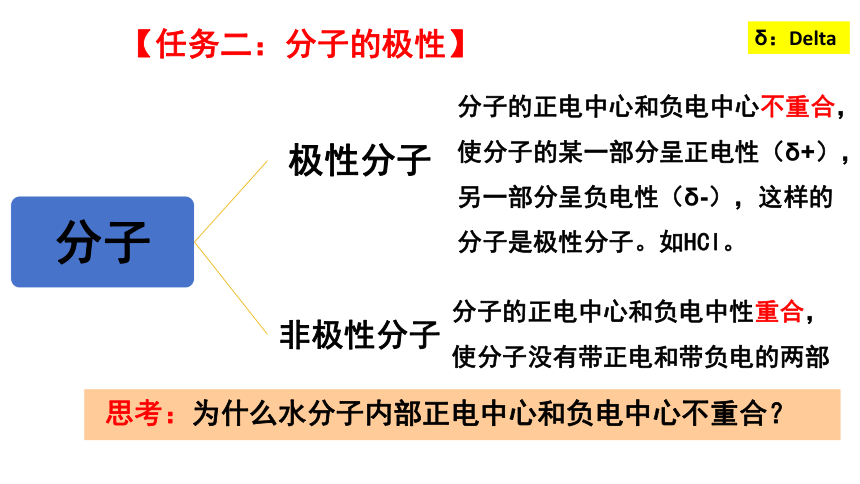
分子的正電中心和負電中心不重合,使分子的某一部分呈正電性(δ+),另一部分呈負電性(δ-),這樣的分子是極性分子。如HCl。
分子的正電中心和負電中性重合,使分子沒有帶正電和帶負電的兩部
【任務二:分子的極性】
思考:為什么水分子內部正電中心和負電中心不重合?
δ:Delta
①若分子中共價鍵的極性的向量和等于0,則分子中沒有帶正電和帶負電的兩部分,為非極性分子,如BF3、CH4等。
從向量的角度理解分子的極性
實例
解釋
3個F所帶負電的負電中心與B的正電中心重合
極性的向量和等于0
4個H所帶正電的正電中心與C的負電中心重合
極性的向量和等于0
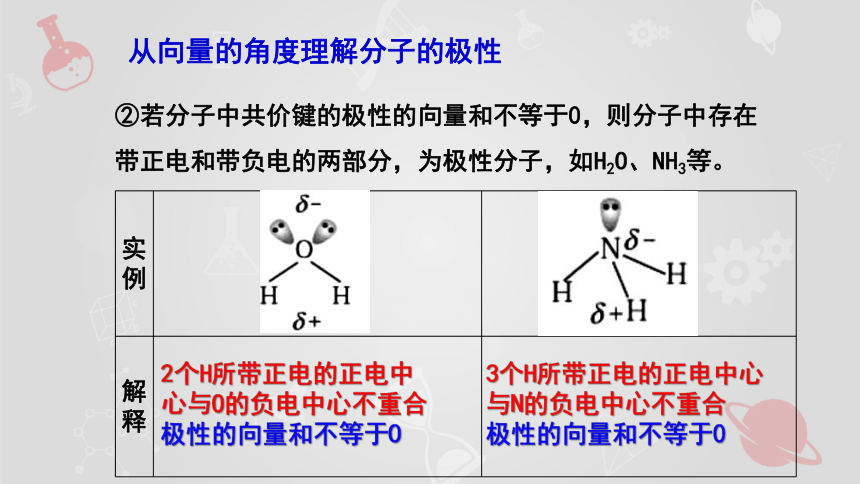
②若分子中共價鍵的極性的向量和不等于0,則分子中存在帶正電和帶負電的兩部分,為極性分子,如H2O、NH3等。
實例
解釋
2個H所帶正電的正電中心與O的負電中心不重合
極性的向量和不等于0
3個H所帶正電的正電中心與N的負電中心不重合
極性的向量和不等于0
從向量的角度理解分子的極性
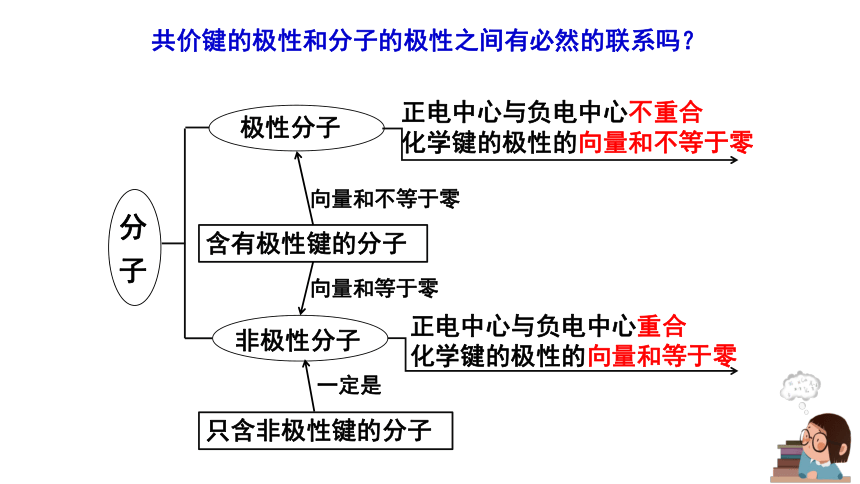
分 子
極性分子
非極性分子
正電中心與負電中心不重合
化學鍵的極性的向量和不等于零
正電中心與負電中心重合
化學鍵的極性的向量和等于零
只含非極性鍵的分子
含有極性鍵的分子
向量和不等于零
向量和等于零
一定是
共價鍵的極性和分子的極性之間有必然的聯系嗎?
是一種重要物質。大氣高空的臭氧層;
保護了地球生物的生存;空氣質量預報中臭氧含量是空氣質量的重要指標;它還是有機合成的氧化劑、替代氯氣的凈水劑……
臭氧分子的空間結構與水分子的相似,
臭氧分子中的共價鍵是極性鍵,
臭氧分子有極性,但很微弱。
僅是水分子的極性的28%。
其中心氧原子是呈正電性的,
而端位的兩個氧原子是呈電負性的。
臭氧是極性分子
【資料卡片】
常見的極性分子和非極性分子
如何判斷分子的極性?
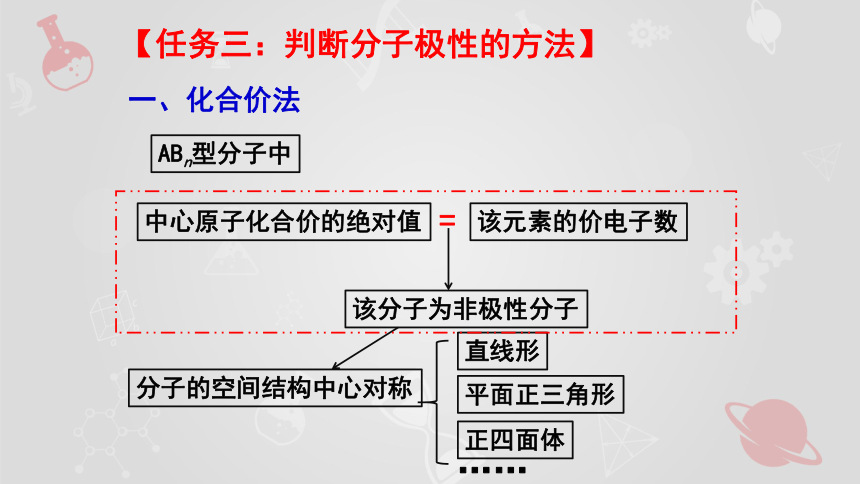
一、化合價法
ABn型分子中
中心原子化合價的絕對值
該元素的價電子數
=
該分子為非極性分子
分子的空間結構中心對稱
直線形
平面正三角形
正四面體
……
【任務三:判斷分子極性的方法】
ABn型分子中
中心原子化合價的絕對值
該元素的價電子數
≠
該分子為極性分子
分子的空間結構不中心對稱
V形
三角錐形
四面體
……
【任務三:判斷分子極性的方法】
一、化合價法
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合價絕對值
價電子數
分子極性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非極性
非極性
非極性
非極性
極性
極性
極性
【任務三:判斷分子極性的方法】
一、化合價法
二、根據分子的空間結構判斷
分子類型 價電子對數 空間結構 分子極性 代表物
A2
AB
AB2
AB3
AB4
2+0
2+1
2+2
直線形
V形
V形
非極性分子
極性分子
極性分子
CO2、CS2
SO2、
H2O、H2S
3+0
3+1
平面三角形
三角錐
非極性分子
極性分子
BF3、AlCl3
NH3、PCl3
4+0
正四面體
非極性分子
CH4、CCl4
直線形
非極性分子
極性分子
O2、H2
HF、CO
【任務三:判斷分子極性的方法】
含孤對電子對
根據圖2-18,思考和回答下列問題:
(1)以下雙原子分子中,哪些是極性分子,哪些是非極性分子 H2O2 、Cl2、HCl
(2)P4和C60是極性分子還是非極性分子
(3)以下化合物分子中,哪些是極性分子,哪些是非極性分子 CO2、HCN、H2O、NH3、BF3、CH4、CH3Cl
H2O2、 HCl是極性分子, Cl2 是非極性分子
HCN、H2O、NH3、CH3Cl是極性分子,
CO2、 BF3、CH4是非極性分子
P4和C60是非極性分子
【課堂練習】
①稀有氣體分子是非極性分子,但不含共價鍵
②臭氧是極性分子,共價鍵為極性鍵
③H2O2是由極性鍵和非極性鍵構成的極性分子
【任務三:判斷分子極性的方法】
科普小能手
表面活性劑
簡要回答表面活性劑的去污原理
表面活性劑在水中會形成親水基團向外,疏水基團向內的膠束,由于油漬等污垢是疏水的,會被包裹在膠束內腔,在摩擦力的作用下油漬脫離,達到去污目的。
【拓展延伸】
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
鈉和水的反應
鈉和乙醇的反應
為什么鈉和水的反應比鈉和乙醇的反應劇烈?
【思考交流】
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推電子基團,使得乙醇分子中的電子云向著遠離乙基的方向偏移,羥基的極性比水分子中的小,因而鈉和乙醇的反應不如鈉和水的劇烈
【任務四:鍵的極性對化學性質的影響】
分子結構
化學鍵的極性
物質的化學性質
【任務四:鍵的極性對化學性質的影響】
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越強
【任務四:鍵的極性對化學性質的影響】
分析表格中pKa數據的變化規律及原因
酸
性
增
強
【學生活動】
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
【學生活動】
烴基是推電子基團,烴基越長,推電子效應越大,使羧基中的羥基的極性越小,羧酸的酸性越弱。
酸
性
增
強
分析表格中pKa數據的變化規律及原因
【學生活動】
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
【釋疑解惑】
CH3
O
H
δ+
δ-
O
C
CH
O
H
δ+
δ-
O
C
Cl
Cl
CH3
O
H
δ+
δ-
O
C
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
酸
性
增
強
由于氯的電負性較大,極性:Cl3C— > Cl2CH— > ClCH2—
導致三氯乙酸中的羧基的極性最大,更易電離出氫離子
【釋疑解惑】
展開更多......
收起↑
 資源預覽
資源預覽