資源簡介
資源簡介
(共59張PPT)
2025年高考化學考向分析
新情境下氧化還原反應方程式
的書寫及相關計算
新情境下氧化還原反應方程式的書寫
大招3 對應練習
解題覺醒
第一步:標變價、列變化、求總數、定系數(變價元素原子守恒)。
第二步:除、 外的未變價元素原子守恒(化學方程式)或調平電荷(離子方程式)。
第三步:看補,用 檢查。
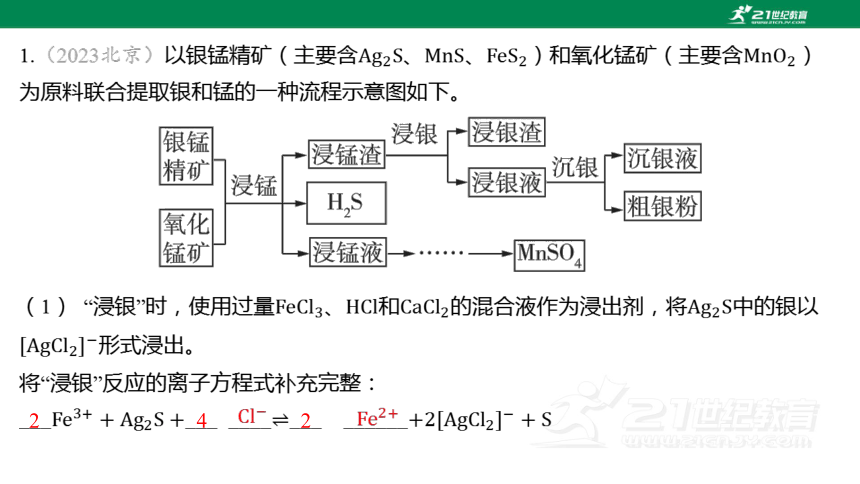
1.(2023北京)以銀錳精礦(主要含、、)和氧化錳礦(主要含 )
為原料聯合提取銀和錳的一種流程示意圖如下。
(1) “浸銀”時,使用過量、和的混合液作為浸出劑,將 中的銀以
形式浸出。
將“浸銀”反應的離子方程式補充完整:
______ _______ ______
2
4
2
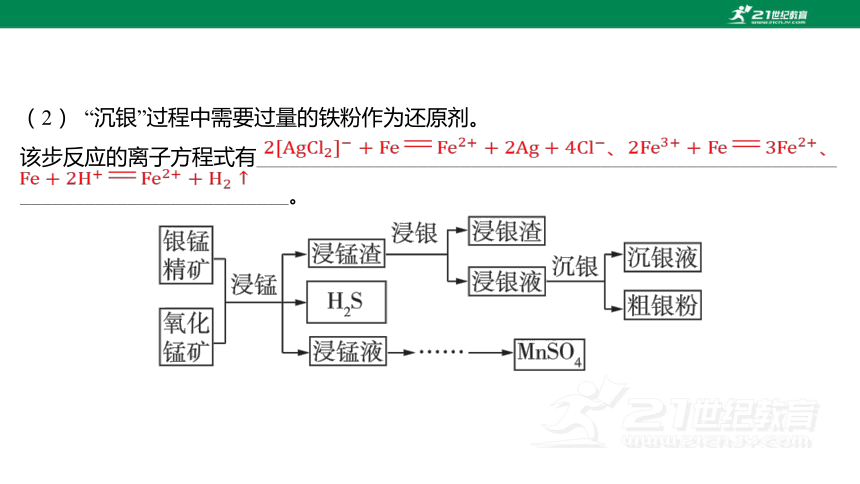
(2) “沉銀”過程中需要過量的鐵粉作為還原劑。
該步反應的離子方程式有______________________________________________________
_________________________。
、、
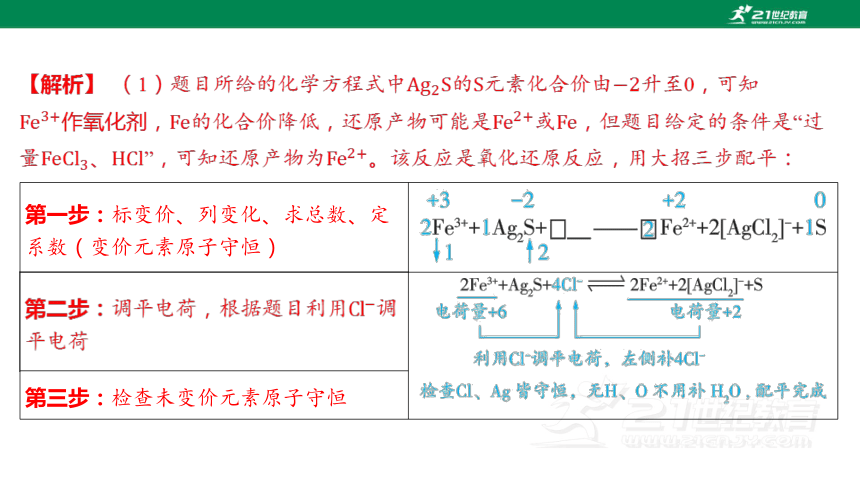
【解析】 (1)題目所給的化學方程式中的元素化合價由 升至0,可知
,的化合價降低,還原產物可能是或 ,但題目給定的條件是“過
量、”,可知還原產物為 。該反應是氧化還原反應,用大招三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒) ________________________________________________________________________________________________________
第二步:調平電荷,根據題目利用 調 平電荷 ________________________________________________________________________________________________________
第三步:檢查未變價元素原子守恒 (2)根據題目信息,浸銀(【特別注意】浸銀步驟加入的、 過量,因此浸銀
液中有、,會在沉銀步驟中與反應,離子反應為 、
,這兩個離子方程式千萬不能遺忘)后的 在沉銀步驟中
與反應,將價還原成得到粗銀粉,且由于粉過量,可確定 的最終氧化產
物是而非 ,該反應為氧化還原反應,用大招三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒) __________________________________________________________________________________
第二步:調平電荷,根據題目利用 調 平電荷 ___________________________________________________________________________________________
第三步:檢查未變價元素原子守恒 杰哥支招
2.(2023河南商丘回民中學期末)和 都是鋰離子電池的電極材料,可
利用鈦鐵礦(主要成分為,還含有少量、 等雜質)來制備,部分工藝流
程為鈦鐵礦 濾液沉淀 。
寫出“高溫煅燒”中由制備 的化學方程式:
__________________________________________________。
【解析】 根據題目信息“沉淀 ”,先寫出反應物與生成
物:(【關鍵】 作還原劑,本身
被氧化成,這是教材有且必須知道的知識點,題目不會給信息。此外, 屬于
碳酸鹽,高溫下最終也會分解生成 ,這些都是書寫陌生化學方程式時必備的知識)。
經判斷是氧化還原反應,使用大招三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒,注意反應物 腳標) _______________________________________________________________________________________________________
第二步:除、 以外未變價元素原子守 恒(本題中、C、 守恒) _______________________________________________________________________________________________________
第三步:看補,用 檢查
看補:左側,右側補 用 檢
查:左側,右側 ,配平完成
3.(2021全國甲)碘(紫黑色固體,微溶于水)及其化合物廣泛用于醫藥、染料等方面。
回答下列問題:
以為原料制備的方法:先向溶液中加入足量的 ,生成碘化物;再
向混合溶液中加入溶液,反應得到。上述制備 的總反應的離子方程式為
_______________________________________。
【解析】 分析題目信息,“先向溶液中加入足量的 ,生成碘化物”,說明
生成了含的物質;“再向混合溶液中加入溶液,反應得到”,說明加入 溶
液,將再氧化成。 為中間產物,反應過程中生成但隨即在下一步又反應掉,
因此“總反應”為(【關鍵】中為 價,化合價升高為
價,即在水溶液中被氧化為 ,此為必須知道的知識點,題目中不會給信息)
(未配平)。經判斷是氧化還原反應,用大招三步配平:
第一步:標變價、列變化、求總數、 定系數(變價元素原子守恒) ____________________________________________________________________
第二步:調平電荷 ________________________________________________________________________________________________________
第三步:看補,用 檢查
看補:左側,右側,補 用O
檢查:左側,右側 ,配平完成
制備的總反應的離子方程式為 。
4.(2021湖南) 可用于催化劑載體及功能材料
的制備。天然獨居石中,鈰主要以 形式存在,
還含有、、、 等物質。以獨居石為
原料制備 的工藝流程如下:
回答下列問題:
(1) “沉鈰”過程中,生成 的離子方程式為______________________
______________________________________________________________________。
(2) 濾渣Ⅱ的主要成分為 ,在高溫條件下,
、葡萄糖和 可制備電極材料
,同時生成和 ,該反應的化學方程式為___
__________________________________________________
__________________________________________________。
【解析】 (1)分析流程圖可知,經焙燒、水浸后
轉化為可溶于水的,溶液中含有 ,加入
,與、 反應轉化為
沉淀,反應過程中 的化合價沒有變化,
是非氧化還原反應。先按題目信息寫出反應物和生成物:
(未配平)。令最
復雜項 的計量數為“1”,根據原子守恒與
電荷守恒,可確定的計量數為2、 的計量數為6,
即 ;此時方程式
右側少,根據原子守恒,產物再加 ,即
(【說明】與、 發生反應生成
與,溶液中的再和 反應生成
,可知產物有 是合理的。此反應和歷屆高考常考
查的“用沉”類似,與 反應最
后生成和 ,可以進行類比(類比法));最后
再看補,用 檢查,即離子方程式為
。(2)分析題目信息,先寫出反應物與生成物:
(未配平)。經判斷是氧化還原反應,根據大招三步配平:
第一步:標變價、列變化、求總 數、定系數 (變價元素原子守恒,注意反應物 腳標) ________________________________________________________________________________________________________
根據、 原子守恒可知,
,再利用化合價升降
守恒,可知計量數為6, 計量數為3
第二步:除、 以外未變價元素原 子守恒(本題中、 守恒) 第三步:看補,用 檢查 6
看補左側,右側補用 檢查:左
側,右側 ,配平完成
因此該反應的化學方程式為
。
5.(2022河北)以焙燒黃鐵礦 (雜質為石英等)產生的紅渣為原料制備銨鐵藍
顏料。工藝流程如下:
(1) 紅渣的主要成分為____________(填化學式),濾渣①的主要成分為_____
(填化學式)。
(2) 還原工序中,不生成 單質的反應的化學方程式為___________________________
_____________________。
、
【解析】 (1)由題目信息可知,紅渣是焙燒黃鐵礦 (雜質為石英等)產生的,反
應原理為 (【關鍵】本反應為教材中“工業制硫酸”的
第一步反應(生成 ),這個反應必須知道,題目不會給信息),因此產生的紅渣的
主要成分為、 (石英的主要成分為二氧化硅)。分析題目流程圖可知,向紅
渣中加入足量的的溶液并加熱充分酸浸,與 反應生成可溶的
,過濾出的濾渣①的主要成分為 。(2)分析題目流程圖可知,還原工序
中加入,將溶液中的還原為,再結合題干信息“不生成 單質”
可知,中價的最終在溶液中被氧化成價 。(【說明】在高中考試中
價升價,考慮0價、價、價,由于題目要求不生成單質,排除0價,且
能將價氧化成價,因此最終產物就是價,在溶液中就是 )由以上分析
寫出反應物與生成物: (未配平)。經判斷此為氧化還原
反應,按照大招三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒,注意反應物 腳標) ______________________________________________________________________________
第二步:調平電荷,根據題目可知用 調平電荷 ________________________________________________________________________________________________________
第三步:看補,用 檢查 ________________________________________________________________________________________________________
因此該反應的化學方程式為 。
氧化還原反應有關計算
6.(2023湖南)油畫創作通常需要用到多種無機顏料。研究發現,在不同的空氣濕度和
光照條件下,顏料雌黃 褪色的主要原因是發生了以下兩種化學反應:
下列說法正確的是( )
D
A.和 的空間結構都是正四面體形
B.反應Ⅰ和Ⅱ中,元素和 都被氧化
C.反應Ⅰ和Ⅱ中,參加反應的:Ⅰ Ⅱ
D.反應Ⅰ和Ⅱ中,氧化 轉移的電
子數之比為
【解析】 的中心原子 的雜化方
式為,且中心 原子上無孤電子對,
的空間結構是正四面體形; 可視
為中的1個被1個替換,中心 原子上
無孤電子對,且形成了3個 鍵和1個 鍵,但兩種鍵的鍵長不一樣,故其
空間結構是四面體形而不是正四面體形。
中的化合價為,反應Ⅰ產物中的化合價也為 ,反應Ⅱ產物
中的化合價為,由此可知,反應Ⅰ中元素 未被氧化。
根據題給反應物與生成物信息寫出化學方程式,反應Ⅰ為
,反應Ⅱ為
,
則反應Ⅰ和Ⅱ中,參加反應的:Ⅰ Ⅱ。
經過反應Ⅰ生成 和
,的化合價沒有變, 的化合價由
變為,則 失去電子
; 經過反應Ⅱ生成
和,的化合價由 變為
,的化合價由變為 ,則
失去電子
,因此反應Ⅰ
和Ⅱ中,氧化 轉移的電子數之比
為 。
7.(2020全國Ⅱ)氯的許多化合物既是重要的化工原料,又是高效、廣譜的滅菌消毒劑。
回答下列問題:
(1) 為淡棕黃色氣體,是次氯酸的酸酐,可由新制的和 反應來制備,該反
應為歧化反應(氧化劑和還原劑為同一種物質的反應)。上述制備 的化學方程式為
__________________________。
(2) 常溫下為黃色氣體,易溶于水,其水溶液是一種廣譜殺菌劑。一種有效成分
為、、 的“二氧化氯泡騰片”,能快速溶于水,溢出大量氣泡,得
到溶液。上述過程中,生成的反應屬于歧化反應,每生成 消耗
的量為_____ ;產生“氣泡”的化學方程式為
_________________________________________。
1.25
(3) “84”消毒液的有效成分為 ,不可與酸性清潔劑混用的原因是_____________
________________________________________________________________________
(用離子方程式表示)。工業上是將氯氣通入的溶液中來制備 溶液,
若溶液中的質量分數為,則生產 該溶液需消耗氯氣的質量為
_____ (保留整數)。
203
【解析】 (1)根據新制的和反應制備 且該反應為歧化反應可知,只有氯元
素的化合價發生變化,由0價變為價和 價。歧化反應是氧化還原反應,利用大招三
步配平:(如果方程式只有4種物質,往往用原子守恒配平更快,但還是要培養好氧化
還原配平能力,如果有類似求轉移電子數的計算題,那就可以輕松給出答案)
第一步:標變價、列變化、求總數、定系數 (變價元素原子守恒,歧化反應由后往前配 平,且要注意生成物的腳標) _____________________________________________________________________________
第二步:除、 以外未變價元素原子守恒 (本題是 的守恒) 第三步:看補,用 檢查 本化學方程式中沒有 ,因此不用補
;用檢查:左右都是1個 ,配平完
成
(2)由題意可知,在生成的過程中,發生歧化反應, 既是氧化劑,
又是還原劑,本題可以運用電子得失守恒分析轉移電子的物質的量:
由關系式可知,每生成,需消耗,所以每生成 ,需消
耗即。反應物中有、,而電離出的 會
與電離出的反應生成 “氣泡”,反應的化學方程式為
。
(3)“84”消毒液遇到酸性清潔劑(【點撥】聯想潔廁靈,主要成分為 )能發生氧化
還原反應:。 有毒,故“84”消毒液不能和酸性清潔
劑混用。由題目信息可知,溶液中 的質量
。將氯氣通入的 溶液中,設反應中消耗
的質量為 ,則:
需要的溶液的質量為 。
溶液的質量溶液的質量 的質量,
,解得 。
1.(2023江蘇南京六校聯考)過二硫酸是一種硫的含氧酸,化學式為 ,其結構可
以表示成 。它的鹽稱為過二硫酸鹽,在工業上用途廣泛,用作強氧化劑
等。 分別與過二硫酸鹽和高錳酸鹽反應的離子方程式(未配平)為
Ⅰ. ,
Ⅱ. 。下列說法錯誤的是( )
D
A.過二硫酸根離子中顯價的氧原子和顯價的氧原子的數目之比是
B.反應Ⅰ中氧化劑和還原劑的物質的量之比是
C.反應Ⅱ中每生成,轉移電子的物質的量為
D.若反應Ⅰ和反應Ⅱ中消耗的 的物質的量相同,則反應Ⅰ和反應Ⅱ中消耗的氧化劑
的物質的量之比為
【解析】 過二硫酸中的化合價為,的化合價為 ,結合過二硫酸的結構和
化合物中各元素的化合價代數和為0可知,過二硫酸根離子中顯價的氧原子和顯 價
的氧原子的數目之比是 。
配平反應Ⅰ., 是還原劑,
過二硫酸根離子是氧化劑,氧化劑和還原劑的物質的量之比為 。
配平反應Ⅱ. ,每生成
轉移電子,則每生成,轉移電子的物質的量為 。
反應Ⅰ中消耗時,消耗氧化劑;反應Ⅱ中消耗 時,消
耗氧化劑,則消耗等物質的量的 時,反應Ⅰ和反應Ⅱ中消耗的氧化劑的物質的
量之比為 。
2.(2023湖南株洲一中檢測)我國發現超級錸礦,錸 是一種熔點高、耐磨、耐腐蝕
的金屬,廣泛用于航天航空等領域。工業上用富錸渣(含 )制得錸粉,其工藝流程
如圖所示:
回答下列問題:
(1) 錸不溶于鹽酸,可溶于稀硝酸生成強酸高錸酸 ,請寫出反應的離子方程
式:___________________________________________。
(2) 用高錸酸銨和氫氣反應制取單質錸的化學方程式為__________________________
_________________;
此反應過程中,實際消耗 的量大于理論值,其原因是___________________________
_________________________。
除作還原劑外,還作保護氣,用于排盡裝置內空氣等
【解析】 (1)根據錸可溶于稀硝酸生成強酸高錸酸可知,反應物為 和
(強酸,可拆寫成離子),生成物為(強酸,可拆寫成離子)以及 ,該
反應中元素化合價有變化,是氧化還原反應,用大招三步配平:
第一步:標變價、列變化、求總 數、定系數(變價元素原子守恒) __________________________________________________________________________
第二步:調平電荷,根據題目信息 可知用 調平電荷 __________________________________________________________________
第三步:看補,用 檢查
看補左側,右側補
用檢查:左側,右側 ,配平完成
(2)由題目信息可知,氫氣作為還原劑,將中價還原成 單質,銨鹽受
熱分解生成氨氣,該反應是氧化還原反應,用大招三步配平:
第一步:標變價、列變化、求總 數、定系數(變價元素原子守恒) ________________________________________________________________
第二步:除、 外的未變價元素原 子守恒(此處需要配平未變價的 ) 2
第三步:看補,用 檢查
看補左側,右側,右側補
用檢查:左側,右側 ,配平完成
得到錸粉時,為防止單質錸被空氣中的氧氣氧化,反應開始時,需要用氫氣排盡裝置內
空氣,反應結束時,需要用 作為保護氣,所以反應過程中,實際消耗氫氣的量大于
理論值。
3.(2023江蘇南京學情調研) 是一種鋰離子電池的正極材料。用生產高錳酸鉀
過程中產生的廢渣(主要成分為、、、 )和硫鐵礦(主要成分為
)制備 的工藝流程如下:
已知:酸浸液主要含有、、、等金屬陽離子。酸浸時與 反
應生成和 的離子方程式為_____________________________________________
_____________。保持溫度、浸取時間不變,能提高錳元素浸出率的措施有___________
_____________________________________________________(任寫兩條)。
適當增加硫酸濃度、將固體原料粉碎(或加快攪拌速率等,合理即可)
【解析】 酸浸時與反應生成和,且根據酸浸液中含有 可知,
反應物轉化為, 化合價發生變化,由此判定該反應為氧化還原反應,用
大招三步配平:
第一步:標變價、列變化、求總 數、定系數(變價元素原子守恒) ______________________________________________________________________
第二步:調平電荷 _______________________________________________________________________________
第三步:看補、用 檢查
看補左側,右側補
用檢查:左側,右側 ,配平完成
4.(2023山東青島調研)工業上用氟磷灰石制白磷 的簡略流程如圖所示。
“爐料”是二氧化硅、過量焦炭和氟磷灰石的混合物,時反應生成 (爐渣)、
白磷、 以及另一種氣體,“電爐”中發生反應的化學方程式為____________________
_________________________________________________________________________。
【解析】 由過量焦炭可知,另一種氣體是;反應物為、 、C,生成
物是、、和 ,初步判斷反應中元素化合價有變化,是氧化還原反應,用
大招三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒) _______________________________________________________________________________________________________
第二步:除、 外的未變價元素原子守 恒(此處需要配平未變價的、、 ) 21
20
1
第三步:用 檢查
用檢查:左右兩側 原子數相同,配平完
成
續表
5.(2023遼寧)某工廠采用如下工藝處理鎳鈷礦硫酸浸取液(含、、 、
、和 ),實現鎳、鈷、鎂元素的回收。
(1) “氧化”中,混合氣在金屬離子的催化作用下產生具有強氧化性的過一硫酸
, 中過氧鍵的數目為____________________。
(或)
(2) “氧化”中,用石灰乳調節,被氧化為 ,該反應的離子方程
式為__________________________________________( 的電離第一步完全,第二
步微弱);濾渣的成分為 、________________(填化學式)。
、
(3) “沉鈷鎳”中得到的(Ⅱ)在空氣中可被氧化成 ,該反應的化學方程式為
___________________________________。
【解析】 (1)可以看成是中一個氫原子被磺酸基 取代的產物,結
構簡式為 ,故1個分子中有一個過氧鍵, 中過氧鍵的數目
為(或)。(2)分析題干信息可知:①“氧化”中被氧化為 ;
分子中含有過氧鍵,具有強氧化性,發生還原反應后價降為價 ;
中為價,反應后化合價沒有變化,在水溶液中最終轉化為;
第一步電離完全,第二步電離微弱,因此在離子方程式中,拆成 。該反應
為氧化還原反應,用大招三步配平:
第一步:標變價、列變 化、求總數、定系數 (變價元素原子守恒) __________________________________________________
補充:過氧鍵反應后的還原產物應為,但由于 可能
在化學方程式左側、右側或甚至消沒了,因此 可以先不
寫,最后一步“看補 ”再寫上即可
第二步:調平電荷 __________________________________________________
第三步:看補 、用 檢查
看補左側,右側,左側補
用檢查:左側,右側 ,配平完成
“氧化”中會被氧化為,用石灰乳調節時,轉化為沉淀,
與結合生成沉淀,故濾渣中還含有、 。
(3)根據題干信息可知,(Ⅱ)在空氣中被氧氣氧化成 ,該反應為氧化還
原反應,用大招三步配平:
第一步:標變價、列變化、求總數、 定系數(變價元素原子守恒,注意反 應物腳標) ______________________________________________________________
說明:作氧化劑,元素由0價被還原為
價,可以先不寫其對應產物,最后一步再調平
原子即可
第二步:除、 以外未變價元素原 子守恒(本題無、 以外的未變價 元素) 4
看補左側,右側,右側少 ,補
用檢查:左側,右側 ,配平完成
第三步:看補、用 檢查 6.(1) (2023福建龍巖三模)探究催化電化學還原的結果。以 溶液為
電解液,在指定的電勢區間,利用催化還原 ,測得陰極產物組分及電流效率
如表所示。
陰極產物
電流效率/% 5 18 30 15
① 該條件下, 還原產物有___種。
② 與 物質的量之比為______。
3
(2) (2024遼寧實驗中學階段測試)在反應
中,當有 水未參加氧化還原反應時,
由還原的為___;由還原的為___;總的被還原的 為___
。
【解析】 (1)①由題表可知,該條件下,的還原產物有、、 ,共3種。
②二氧化碳轉化為的過程中,C的化合價由變為;二氧化碳轉化為 的過
程中,C的化合價由變為,與的電流效率分別為、,則 與
的物質的量之比為 。(2)
方法一 在反應 中,可建立如下關系式:
(還原劑)(未參與氧化還原反應),當有 水未參與氧化還
原反應時,作還原劑的的物質的量為。與 發生氧化還原反應時,根
據得失電子守恒有(氧化劑)(還原劑),則由還原的 為
;此時參加反應的為,與 發生氧化還原反應時,
參與的共有,根據得失電子守恒有 (還原劑)~
(氧化劑)(【點撥】同種物質既作氧化劑,又作還原劑,從得失電子和產物進
行分析:,得到,,失去 。由此可得出反應物之間的
關系),則由還原的為;總的被還原的 為
。
方法二 根據題目信息知, ,則(氧化劑)
(還原劑)(還原劑)(未參與氧化還原反應),且由還原的
與由還原的的物質的量之比為,故當有 水未參與氧化還原反應時,作
氧化劑的的物質的量為,被還原的為 ,被還原的 為
。
7.(生活情境)(2024湖北武漢聯考)化學燙發巧妙利用了
頭發中蛋白質與藥劑發生化學反應的特點,實現對頭發的“定
型”,其變化過程如圖所示。下列說法正確的是( )
D
A.藥劑A表現了氧化性
B.過程若有鍵斷裂,則轉移 電子
C.過程若藥劑B是,其還原產物為
D.化學燙發通過改變頭發中某些蛋白質中 鍵的位置來實
現頭發的定型
【解析】 氫原子添加進去(【速解】對于復雜
有機反應,可根據“加氫去氧為還原,加氧去氫為氧化”快速
判斷),發生還原反應,因此①是氧化劑,具有氧化性,則
藥劑A是還原劑,具有還原性。
過程中由價(【類比遷移】類比過氧鍵,推出①中 元素為
價)變為,若有鍵斷裂,則轉移 電子。
過程發生氧化反應,若藥劑B是 ,則B為氧化劑,氧元素化合價應該
降低,因此其還原產物為水。
通過過程和過程,某些蛋白質中 鍵的位置發生了改變,由此可
知,化學燙發通過改變頭發中某些蛋白質中 鍵的位置來實現頭發的定型。
8.(2023遼寧六校期初考試)硼氫化鈉
是一種溫和且具有化學選擇性
的還原試劑,屬于硼氫化合物家族的成
員,在含有羥基的溶劑 (如水、醇)
中,室溫下能快速地將醛和酮還原;硼
氫化鈉對羰基具有極強的還原性,作為還原劑廣泛地應用于有機合成中。常溫下硼氫化
鈉能與水反應,易溶于異丙胺(沸點為 )。工業上可用硼鎂礦(主要成分是
,含少量雜質)制取 ,其工藝流程如下:
“高溫合成”發生反應的化學方程式為____________________________________________
__________________________________________________________________________。
【解析】 書寫該化學方程式最關鍵的
點是必須知道中的化合價為
(常見的還有,其中 的化合價
也是),則 作還原劑,化合價升
高, 作氧化劑,化合價降低,用大招
三步配平:
第一步:標變價、列變化、求總數、定 系數(變價元素原子守恒,注意反應物 腳標)
第二步:除、 以外未變價元素原子守恒
第三步:看補、用 檢查 謝謝
21世紀教育網(www.21cnjy.com)
中小學教育資源網站
兼職招聘:
https://www.21cnjy.com/recruitment/home/admin
展開更多......
收起↑
 資源預覽
資源預覽