資源簡介
資源簡介
(共43張PPT)
2025年高考化學考向分析
定量型實驗
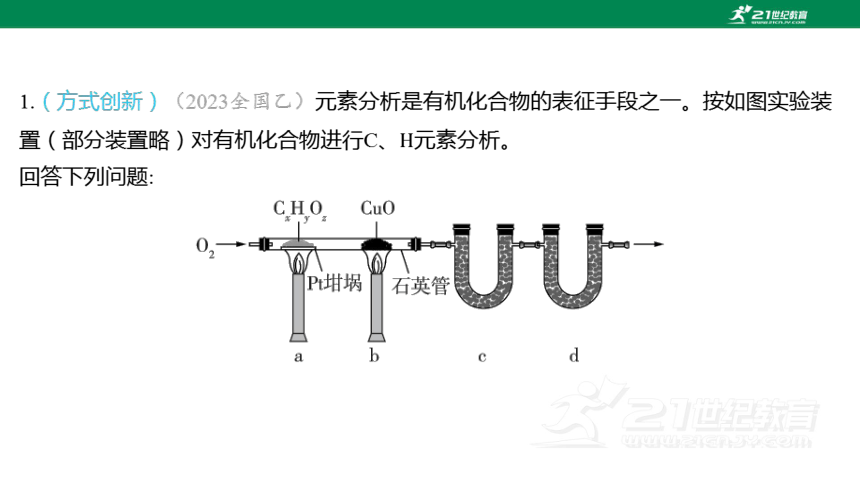
1.(方式創新)(2023全國乙)元素分析是有機化合物的表征手段之一。按如圖實驗裝
置(部分裝置略)對有機化合物進行C、 元素分析。
回答下列問題:
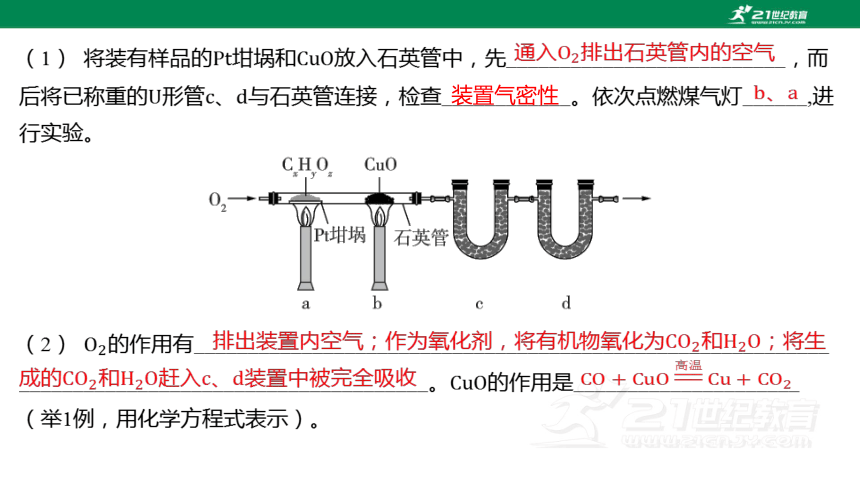
(1) 將裝有樣品的坩堝和 放入石英管中,先__________________________,而
后將已稱重的形管、 與石英管連接,檢查____________。依次點燃煤氣燈______,進
行實驗。
通入排出石英管內的空氣
裝置氣密性
、
(2) 的作用有___________________________________________________________
______________________________________。 的作用是_____________________
(舉1例,用化學方程式表示)。
排出裝置內空氣;作為氧化劑,將有機物氧化為和;將生成的和趕入、裝置中被完全吸收
(3) 和中的試劑分別是___、___(填標號)。和 中的試劑不可調換,理由是
__________________________________。
A.
B.
C.堿石灰
D.
A
C
堿石灰會同時吸收水蒸氣和二氧化碳
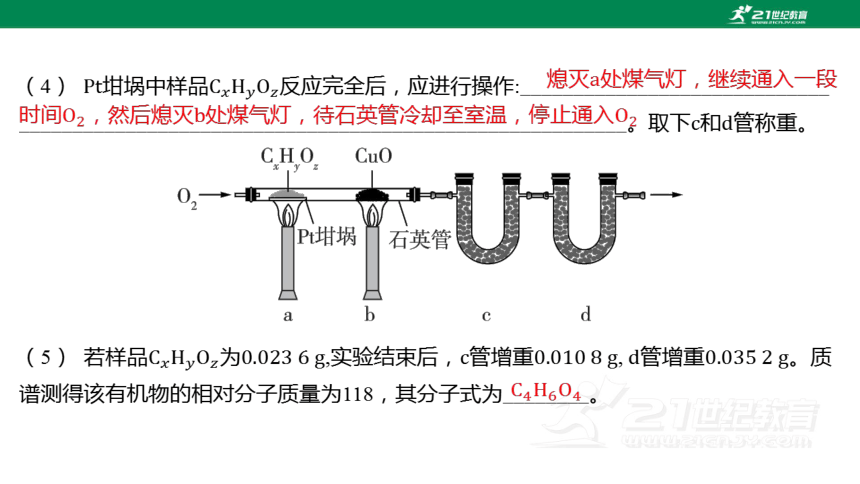
(4) 坩堝中樣品 反應完全后,應進行操作:_____________________________
_________________________________________________________。取下和 管稱重。
熄滅處煤氣燈,繼續通入一段時間,然后熄滅處煤氣燈,待石英管冷卻至室溫,停止通入
(5) 若樣品為,實驗結束后,管增重,管增重 。質
譜測得該有機物的相對分子質量為118,其分子式為________。
【解析】 (1)將裝有樣品的坩堝和放入石英管中,先通入 排出石英管內的空
氣,避免原先石英管內的、干擾實驗測定。再將已稱重的形管、 與石英管
連接,然后檢查裝置氣密性。若坩堝內的有機物不完全燃燒生成,后面的 可作
為氧化劑,在高溫條件下將再氧化為,為了達到該目的,應先點燃 處酒精燈后
再點燃處酒精燈,保證生成的可以完全被氧化為。(2)實驗中 的作用:①可
以排出裝置內空氣;②作為氧化劑,將有機物氧化為和;③持續通入的 ,可
以將生成的和吹送到、裝置中,使其完全被吸收,提高實驗的準確度。
作為氧化劑,將可能生成的氧化為,其化學方程式為 。
(3)有機物燃燒后生成的用吸收,用堿石灰吸收,其中 管
裝、管裝堿石灰,二者不可調換,這是因為堿石灰能同時吸收和 ,若堿
石灰放在前面,增加的重量既有又有,則無法判定原有機物中所含C、 的物質
的量,也就無法確定有機物分子式。(4)坩堝中樣品反應完全后,先關閉 處煤氣燈
(處煤氣燈先不關閉,保證能全被氧化為),由于裝置內仍有殘留的和 ,
因此要繼續通入一段時間,將和吹送至、裝置中,接著熄滅 處煤氣燈,
待石英管冷卻至室溫,再停止通入 。
(5)管裝有無水,用來吸收生成的,因此增重量即為 的質量,據此可計
算原有機物中原子的物質的量; 管
裝有堿石灰,用來吸收生成的,因此增重量為 的質量,據此可計算原有機物中C
原子的物質的量;有機物中 元素的質量為
,其物質的量
;該有機物中C、、 三種元素原子的物質的量
比為,最簡式為 (相對分子質量為59),經質
譜測得該有機物的相對分子質量為118,則其分子式為 。
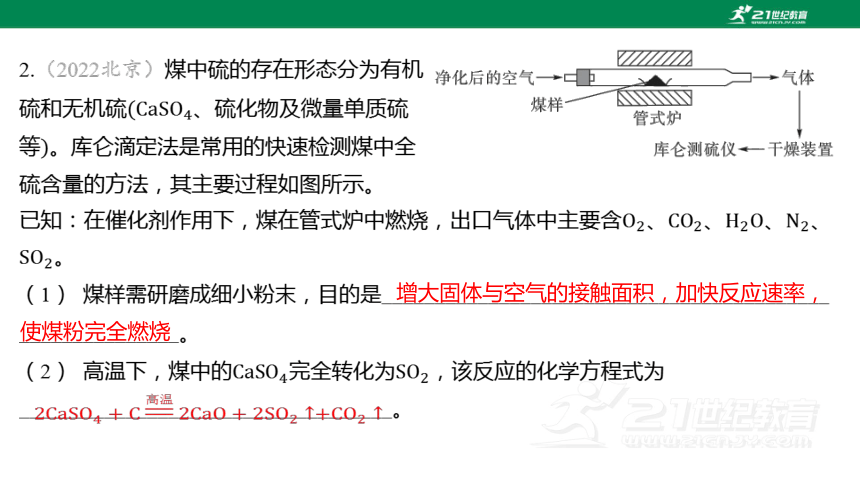
2.(2022北京)煤中硫的存在形態分為有機
硫和無機硫 、硫化物及微量單質硫
等 。庫侖滴定法是常用的快速檢測煤中全
硫含量的方法,其主要過程如圖所示。
已知:在催化劑作用下,煤在管式爐中燃燒,出口氣體中主要含、、、 、
。
(1) 煤樣需研磨成細小粉末,目的是__________________________________________
_______________。
(2) 高溫下,煤中的完全轉化為 ,該反應的化學方程式為
___________________________________。
增大固體與空氣的接觸面積,加快反應速率,使煤粉完全燃燒
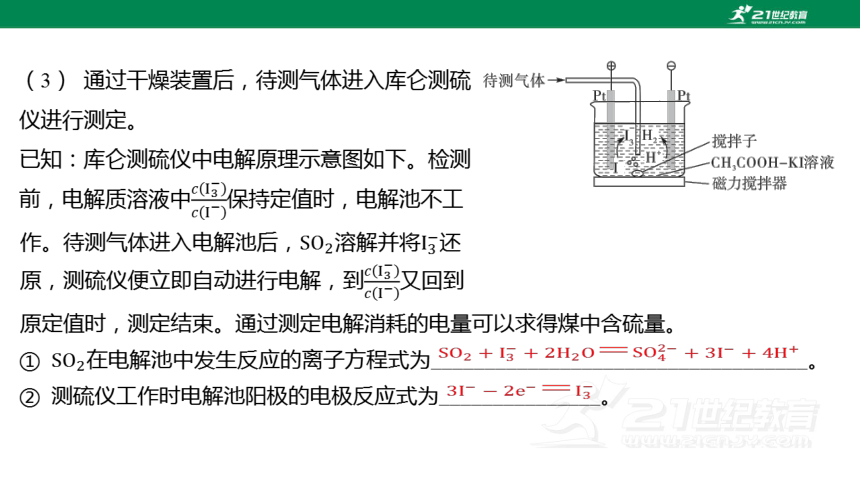
(3) 通過干燥裝置后,待測氣體進入庫侖測硫
儀進行測定。
已知:庫侖測硫儀中電解原理示意圖如下。檢測
前,電解質溶液中 保持定值時,電解池不工
① 在電解池中發生反應的離子方程式為___________________________________。
② 測硫儀工作時電解池陽極的電極反應式為_______________。
作。待測氣體進入電解池后,溶解并將 還
原,測硫儀便立即自動進行電解,到 又回到
原定值時,測定結束。通過測定電解消耗的電量可以求得煤中含硫量。
(4) 煤樣為,電解消耗的電量為 庫侖。
煤樣中硫的質量分數為_______。
已知:電解中轉移 電子所消耗的電量
為96 500庫侖。
(5) 條件控制和誤差分析。
① 測定過程中,需要控制電解質溶液的。當時,非電解生成的 使測得的全
硫含量偏小,生成 的離子方程式為_____________________________。
② 管式爐中煤樣燃燒時會有少量 產生,使測得的全硫含量______(填“偏大”或“偏
小”),該測量結果可進行校正。
偏小
【解析】 (3)①根據題目信息,氣體進入電解池后,溶解并將還原成, 在
水溶液中被氧化成,離子方程式為 。②與
外接電源正極相接的為電解池陽極,在陽極被氧化成 ,電極反應式為
。(4)由與 反應的離子方程式,以及測硫儀工作時電解池的陽極
電極反應式,可以得到關系式,電解消耗的電量為 庫侖,則
,因此 ,則煤樣中硫的質量分數為
。(5)①當時,非電解生成的 使測得的全硫含量偏小,說
明在時溶液有其他反應會生成,推知應該是待測氣體中的將氧化成 。②
煤燃燒時有產生,說明硫元素沒有全部轉化為,測定過程中,溶解到水中的
減少,與反應所生成的會偏少,電解時需要生成的 會偏少,則轉移電子數偏
小,導致測得全硫含量結果偏小。
3.(2020天津)為測定 溶液的濃度,甲、乙兩同學設計了兩個方案。回答下列問
題:
Ⅰ.甲方案
實驗原理:
實驗步驟:
(1) 判斷 沉淀完全的操作及現象為_____
__________________________________________。
向上層清液中繼續滴加溶液,無白色沉淀生成
(2) 步驟②判斷沉淀是否洗凈所選用的試劑為____________。
(3) 步驟③灼燒時盛裝樣品的儀器名稱為______。
(4) 固體質量為,則____ 。
溶液
坩堝
(5) 若步驟①從燒杯中轉移沉淀時未洗滌燒杯,
則測得 ______(填“偏高”“偏低”或“無
影響”)。
偏低
Ⅱ.乙方案
實驗原理:
實驗步驟:
①按如圖連接方式安裝裝置(夾持儀器略去)
②……
③在儀器A、B、C、D、 中加入圖示的試劑
④調整D、 中兩液面相平,使D中液面保持在0或略低于0刻度位置,讀數并記錄
⑤將 溶液滴入A中并攪拌,反應完成后,再滴加稀硫酸至體系不再有氣體產生
⑥待體系恢復到室溫,移動管,保持D、 中兩液面相平,讀數并記錄
⑦處理數據
(6) 步驟②為________________。
檢查裝置氣密性
(7) 步驟⑥需保證體系恢復到室溫的原因是___(填序號)。
.反應熱受溫度影響
(8) 粉質量為,若測得體積為,已知實驗條件下 ,則
_ _________ (列出計算表達式)。
.氣體密度受溫度影響
.反應速率受溫度影響
(9) 若步驟 管液面高于D管,未調液面即讀數,則
測得 ______(填“偏高”“偏低”或“無影響”)。
偏高
(10) 是否能用同樣的裝置和方法測定 溶液的濃度:____(填“是”或“否”)。
否
【解析】 原理對接 甲方案的測定原理是將 轉化
為,然后稱量出 的質量,再根據關系式
求出 的物質的量。因此實驗中需
要準確地獲得的質量。乙方案的原理是根據鋅能與、 反應,先用足量的鋅
與一定量的 溶液反應,然后用足量的稀硫酸與鋅反應,測量出生成的氫氣的體積,
由此計算出與硫酸反應消耗掉的鋅的量,最后再根據與 溶液反應的鋅的量求出
的物質的量,最后求出 溶液的物質的量濃度。
(1)加入溶液后,若已經完全沉淀,則向上層清液中繼續加入 溶液時
就不會產生新的沉淀,故相應的檢驗方法是向上層清液中加入 溶液,沒有白色沉
淀出現,說明沉淀完全。(2)沉淀中所含有的雜質為、 ,可用
溶液檢驗最后一次洗滌液中是否含有 的方法來
達到目的。(3)灼燒固體時通常在坩堝中進行。(4)
的物質的量是,由“ ”守恒可知
,
。(5)
由于燒杯內壁會沾有一定量 ,因此若不洗滌燒杯,
會導致損失,由此計算出的 的量少于理論
值,從而導致測量出的 溶液濃度偏低。(6)由于
實驗涉及氣體,故裝置連接好后應檢查裝置的氣密性。
(7)由于氣體密度受溫度影響,故要想準確測量氫氣
的體積,必須保證反應前后體系溫度相等,故答案為 。
(8)消耗的鋅的物質的量為 ,生成的
,因此與反應的 的物質的
量為 ,故
。(9)當 管液面高于D
管時,說明C、D中氣體壓強大于大氣壓,這樣測量出
的氣體體積值偏小,由 的計算表達式知測量出
的 偏高。(10)比鎂活潑的金屬都與水反應,
故不能用此方法、此裝置測定 溶液的濃度。
1.(2023陜西名校二聯)碳酸錳 是制造高性能
磁性材料的主要原料。實驗室以 為原料制備少
量并研究其性質,制備 的裝置如圖1所示。
已知: 難溶于水、乙醇,在干燥空氣中穩定,
開始分解。 請回答下列問題:
(1) 儀器B的名稱為______________。
恒壓滴液漏斗
(2) 在燒瓶中加入一定量的 固體粉末,滴加硫
酸酸化的 溶液,其反應的離子方程式為________
________________________________________________,
反應過程中 隨時間的變化曲線如圖2所示,則
反應產生的對反應具有催化作用
(3) 反應一段時間,當裝置A中的溶液由紫色變為無色時,再滴加 溶液,充
分反應生成。生成 的離子方程式為_________________________________
____________________________________________________________________________。
(4) 實驗結束后,將裝置A中的混合物過濾,用乙醇洗滌濾渣,再__________,即得
到干燥的 固體。用乙醇洗滌的優點是____________________________。
低溫烘干
防止潮濕的被空氣氧化
時 迅速增大的原因是___________________________________。
(5) 在空氣中加熱 固體,隨著溫度的升高,殘留固體的質量變化如圖3所示,
則A點的成分為______(填化學式), 反應的化學方程式為___________________
___________________________________________________________________________。
【裝置剖析】
【熱重曲線分析】
實驗 目的 制備少量 并研究其性質
實驗 操作 及相 關分 析 (2)反應過程中隨時間的變化曲線如題圖2所示,時 迅
速增大,其原因是反應產生的 對反應具有催化作用。
(4)在開始分解,故反應制備的 用乙醇洗滌后,應低溫
烘干,得到干燥的固體。 難溶于水、乙醇,在干燥空氣中穩定,
結合易被氧化可知,用乙醇洗滌的優點是防止潮濕的 被空氣氧化
2.(2023山東濟南一中等名校三模)碳酸釤(摩爾質量為 )為
難溶于水的白色粉末,可用于治療高磷酸鹽血癥。回答下列問題:
Ⅰ.實驗室通過將和通入溶液中制備水合碳酸釤
(1) 裝置的連接順序是 __,___ (填接口標號)。
(2) 實驗有不足之處,改進辦法是____________________________________________
_______________。
在甲與丙(或與)之間接一個盛有飽和碳酸氫鈉溶液的洗氣瓶
(3) 生成水合碳酸釤的化學方程式為______
________________________________________
_____________________________________。
(4) 若氨氣過量,溶液堿性太強會生成副產物 ,反應的化學方程式為
___________________________________________________。
Ⅱ.碳酸釤質量分數的測定:
準確稱取產品試樣,溶于稀鹽酸中,加入 緩沖溶液,
加入紫脲酸銨混合指示劑,用 標準溶液滴定至
呈藍紫色,消耗溶液 。
(5) 產品中碳酸釤的質量分數 _______。
Ⅲ.測定 中結晶水的含量:
下圖為測定分解產物的實驗裝置,將裝置A稱重,記為 。將提純
后的樣品裝入裝置A中,再次將裝置A稱重,記為 ,將裝有試劑的裝置C稱重,記
為 。按下圖連接好裝置進行實驗。
實驗步驟:
①打開、和,緩緩通入 ;
②數分鐘后關閉____,打開____,點燃酒精噴燈,加熱裝置A中樣品;
③一段時間后,熄滅酒精噴燈,打開,通入數分鐘后,冷卻到室溫,關閉和 ,
稱量裝置A。重復上述操作步驟,直至裝置A恒重,記為(此時裝置A中為 )。
稱重裝置C,記為 。
(6) 實驗步驟②中關閉________,打開____(填寫止水夾標號)。
、
(7) 計算中結晶水數目_ __________________(用含、 、
的代數式表示)。
【裝置剖析】
實驗目的 制備水合碳酸釤 ,并進行定量測定
實驗計算及 相關分析 (5)根據 得出
,
(7)
________________________________________________________________________________________________________
3.(圖像創新)(2023安徽、云南等四省聯考)醋酸鈷與雙水楊醛縮乙二胺形成的配合
物 具有可逆載氧能力,能模擬金屬蛋白的載氧作用,在催化氧化反應中應
用廣泛。合成反應如下所示,回答下列問題。
Ⅰ.合成
(1) 合成裝置如圖所示。在氮氣的保護下,向含有雙水楊
醛縮乙二胺的乙醇溶液中緩慢滴加醋酸鈷的乙醇溶液,加熱
回流。A處應安裝的儀器是____________(填名稱),B處
應安裝的儀器是______________(填名稱)。裝置C的作用
是______。
球形冷凝管
恒壓滴液漏斗
液封
(2) 回流 ,沉淀轉化為暗紅色晶體。回流結束后進行如下操作:
A.停止通氮氣
B.停止加熱
C.關閉冷凝水
正確的操作順序為_____(填標號)。充分冷卻后將三頸燒瓶中混合物過濾,洗滌并干
燥,得到配合物 。
Ⅱ.載氧量測定
(3) 將質量為的(摩爾質量為 )加入圓底燒瓶中,在恒壓滴液漏斗
中加入(配合物在 中可吸氧),按如圖所示搭建裝置。通入氧氣,趕盡體系內
空氣。檢查裝置氣密性的操作為先關閉______________,然后調節水平儀的水位至與量
氣管水位產生一定液面差。裝置不漏氣的現象是________________。
活塞1和活塞2
液面差恒定不變
(4) 調整水平儀高度,待量氣管水位與水平儀水位齊平時,記錄量氣管水位的體積刻
度為。將 加入圓底燒瓶,待吸氧反應結束后,再次使量氣管水位與水平儀水位齊
平,記錄量氣管水位的體積刻度為。已知大氣壓為,氧氣的壓強為,溫度為 。
配合物載氧量 的計算式為______________。
【裝置剖析】
實驗目的 合成配合物 并測定其載氧量
實驗操作 及相關 分析 (2)回流結束后,應先停止加熱,然后關閉冷凝水,最后停止通氮氣,充
分冷卻后將三頸燒瓶中混合物過濾、洗滌、干燥得到配合物。
(3)由實驗裝置圖可知,檢查裝置氣密性的操作為先關閉活塞1和活塞2,
然后調節水平儀的水位至與量氣管水位產生一定液面差,若液面差穩定,說
明裝置氣密性良好
實驗計算 (4)由題意可知,的物質的量為 。由理想氣體狀態方程
知, 吸收氧氣的物質的量(【易錯提醒】吸收氧氣的體積為
,不要思維定式錯寫成)為 ,則吸收氧氣的物質
的量和的物質的量的比值為
謝謝
21世紀教育網(www.21cnjy.com)
中小學教育資源網站
兼職招聘:
https://www.21cnjy.com/recruitment/home/admin
展開更多......
收起↑
 資源預覽
資源預覽