資源簡介
資源簡介
(共12張PPT)
第五單元 化學(xué)反應(yīng)的定量關(guān)系
課題2 化學(xué)方程式
第一課時(shí) 化學(xué)方程式的意義
3分鐘:預(yù)習(xí)課本117頁
準(zhǔn)備好學(xué)案、草稿本和筆
素養(yǎng)目標(biāo)
1.通過探究化學(xué)方程式的意義,了解化學(xué)方程式的宏觀及微觀信息,搭建“宏觀-微觀-符號(hào)”三重表征思維模型,多角度理解化學(xué)反應(yīng)。
2.通過小組合作探究的方式,會(huì)從質(zhì)、量、數(shù)等方面讀化學(xué)方程式,并能利用化學(xué)方程式求出化學(xué)反應(yīng)中各物質(zhì)的質(zhì)量比,會(huì)從定性和定量的角度分析化學(xué)方程式。
3.通過師生共同合作完成,達(dá)到正確書寫化學(xué)方程式的能力,會(huì)用方程式解決問題,認(rèn)識(shí)定量研究對(duì)化學(xué)發(fā)展的推動(dòng)作用和化學(xué)反應(yīng)實(shí)現(xiàn)物質(zhì)轉(zhuǎn)化的意義和價(jià)值。
【新課引入】
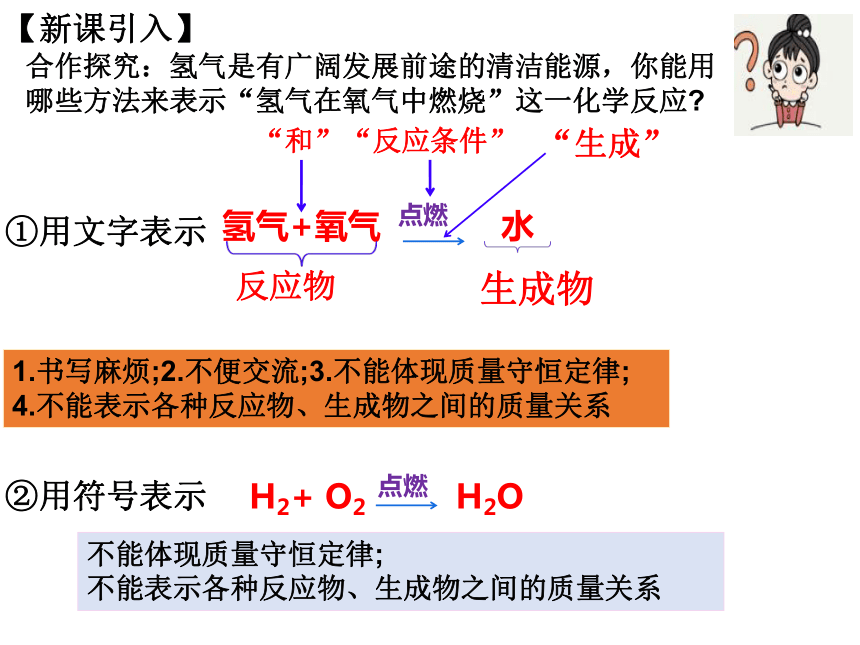
合作探究:氫氣是有廣闊發(fā)展前途的清潔能源,你能用哪些方法來表示“氫氣在氧氣中燃燒”這一化學(xué)反應(yīng)
氫氣+氧氣 水
點(diǎn)燃
①用文字表示
②用符號(hào)表示
H2+ O2 H2O
點(diǎn)燃
【新課引入】
1.書寫麻煩;2.不便交流;3.不能體現(xiàn)質(zhì)量守恒定律;
4.不能表示各種反應(yīng)物、生成物之間的質(zhì)量關(guān)系
反應(yīng)物
生成物
“反應(yīng)條件”
“和”
“生成”
不能體現(xiàn)質(zhì)量守恒定律;
不能表示各種反應(yīng)物、生成物之間的質(zhì)量關(guān)系
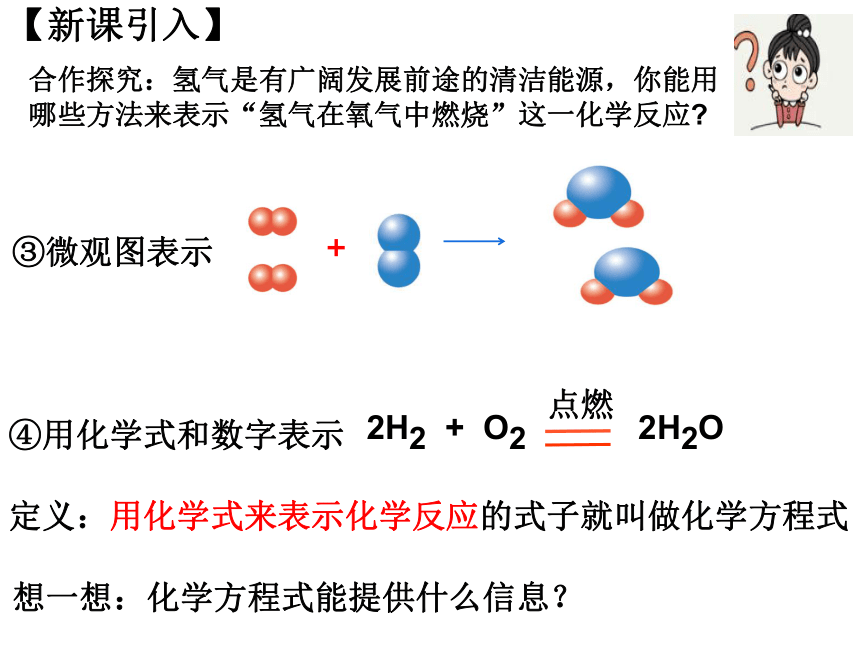
合作探究:氫氣是有廣闊發(fā)展前途的清潔能源,你能用哪些方法來表示“氫氣在氧氣中燃燒”這一化學(xué)反應(yīng)
③微觀圖表示
【新課引入】
+
2H2 + O2 2H2O
點(diǎn)燃
④用化學(xué)式和數(shù)字表示
定義:用化學(xué)式來表示化學(xué)反應(yīng)的式子就叫做化學(xué)方程式
想一想:化學(xué)方程式能提供什么信息?
意義 化學(xué)方程式的意義
定性的關(guān)系 (物質(zhì)的轉(zhuǎn)化關(guān)系)
定量意義 (粒子個(gè)數(shù)比)
定量的關(guān)系 (物質(zhì)質(zhì)量比)
通過相對(duì)分子質(zhì)量或相對(duì)原子質(zhì)量與化學(xué)計(jì)量數(shù)的乘積計(jì)算各物質(zhì)的質(zhì)量比。
2 : 1 : 2
微觀粒子個(gè)數(shù)比
質(zhì)量比
4 : 32 : 36
任務(wù)一:化學(xué)方程式的意義
2H2 + O2 2H2O
點(diǎn)燃
氫氣和氧氣在點(diǎn)燃的條件下生成水
2個(gè)氫分子和1個(gè)氧分子在點(diǎn)燃的條件下反應(yīng)生成1個(gè)二氧化碳分子。
每4份質(zhì)量的氫氣與32份質(zhì)量的氧氣在點(diǎn)燃的條件下反應(yīng)生成44份質(zhì)量的二氧化碳。
粒子個(gè)數(shù)比即化學(xué)式前面的化學(xué)計(jì)量數(shù)之比
【思考與討論】
從定性和定量的角度分析以下反應(yīng)的化學(xué)方程式,你能從中獲得哪些信息
我國早在西漢時(shí)期就發(fā)現(xiàn)鐵與硫酸銅溶液反應(yīng)會(huì)生成銅,
該反應(yīng)的化學(xué)方程式為:
Fe + CuSO = Cu + FeSO
相對(duì)原子質(zhì)量
0-16、S-32、Fe-56、Cu-64
56 : (64+32+16×4) : 64 :(56+32+16×4)
56 : 160 : 64 : 152
鐵和硫酸銅反應(yīng)生成銅和硫酸亞鐵
定性
鐵、硫酸銅、銅、硫酸亞鐵的粒子個(gè)數(shù)比是1:1:1:1
定量
每56份質(zhì)量的鐵和160份質(zhì)量的硫酸銅反應(yīng)生成64 份質(zhì)量的銅和152份質(zhì)量的硫酸亞鐵
定量
我國早在西漢時(shí)期就發(fā)現(xiàn)鐵與硫酸銅溶液反應(yīng)會(huì)生成銅,
該反應(yīng)的化學(xué)方程式為:
Fe + CuSO = Cu + FeSO
相對(duì)原子質(zhì)量
0-16、S-32、Fe-56、Cu-64
56 : 160 : 64 : 152
56g質(zhì)量的鐵和160g質(zhì)量的硫酸銅反應(yīng),固體質(zhì)量增加了8g,溶液質(zhì)量減少了8g
從定性和定量的角度分析以下反應(yīng)的化學(xué)方程式,你能從中獲得哪些信息
質(zhì)量守恒
比例關(guān)系
56 + 160 = 64 + 152
典例: 從反應(yīng)的化學(xué)方程式3Fe+202 Fe304中,可得到下列信息,其中敘述錯(cuò)誤的是( )
A.反應(yīng)物是鐵和氧氣,生成物是四氧化三鐵
B.3份Fe跟2份02反應(yīng),生成1份Fe304
C.每168份質(zhì)量的Fe跟64份質(zhì)量的02完全反應(yīng),能生成232份質(zhì)量的Fe304
D.在這個(gè)反應(yīng)中,鐵、氧氣、四氧化三鐵的質(zhì)量比是168:64:232
=
點(diǎn)燃
B
相對(duì)原子質(zhì)量
0-16 Fe-56
1、請(qǐng)根據(jù)下列微觀圖示寫出化學(xué)方程式:
+
點(diǎn)燃
2CO + O2 = CO2
點(diǎn)燃
C
O
當(dāng)堂檢測
2.《天工開物》中記載了火法煉鋅的工藝,主要發(fā)生反應(yīng)2C+ZnC03 Zn+3C0 ,從中不能獲得的信息是( )
A.反應(yīng)物的質(zhì)量比 B.生成物有兩種
C.反應(yīng)條件是高溫 D.反應(yīng)速率很快
當(dāng)堂檢測
=
高溫
D
3.紅磷在氧氣中燃燒生成五氧化二磷,反應(yīng)的化學(xué)方程式為
4P+502 2P205,在這個(gè)反應(yīng)中,紅磷、氧氣、五氧化二磷的質(zhì)量比是( )
A.31:32:142 B.31:32:71
C.31:160:284 D.31:40:71
=
點(diǎn)燃
D
4.從氫氣在氧氣中燃燒的化學(xué)方程式: 中獲得以下信息:①該反應(yīng)的發(fā)生條件是點(diǎn)燃;②該反應(yīng)的反應(yīng)物是氫原子和氧原子;③反應(yīng)前后元素種類不變:④反應(yīng)前后原子數(shù)目不變:⑤反應(yīng)前后分子總數(shù)保持不變;⑥在反應(yīng)中氧氣和水的質(zhì)量比為8:9。其中正確的是( )
A.①②③④ B.②④⑤⑥
C.①③④⑥ D.②③④⑥
2H2 + O2 2H2O
=
點(diǎn)燃
C
當(dāng)堂檢測
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽