資源簡介
資源簡介
(共25張PPT)
第二部分 專題突破
專題四 工藝流程圖題
專題精講
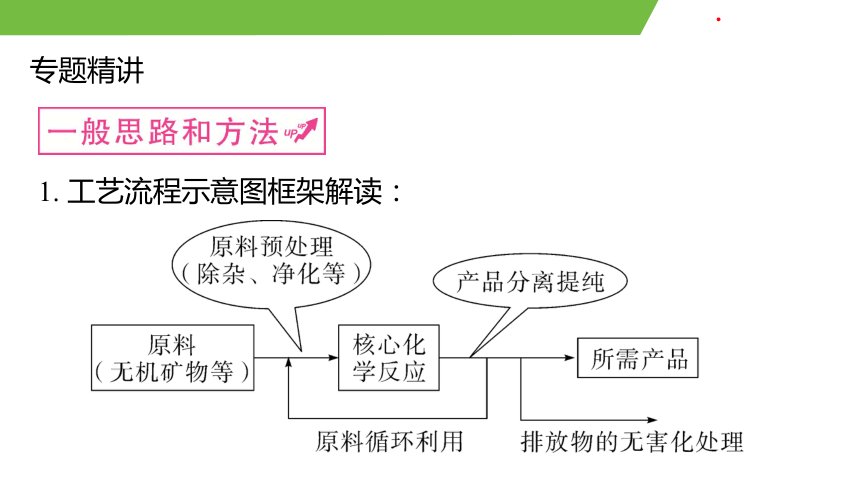
1. 工藝流程示意圖框架解讀:
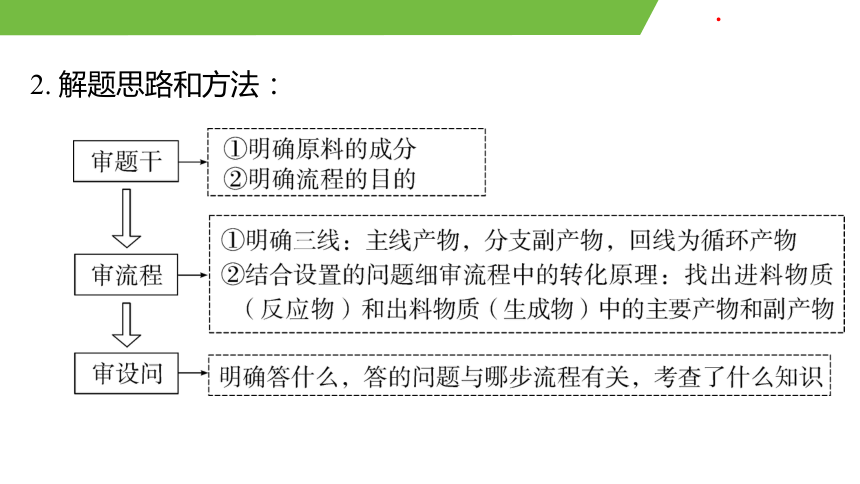
2. 解題思路和方法:
考查角度
1. 原料的預處理:流程中所用的原料通常要進行預處理,如粉
碎或研磨、水浸、酸浸、灼燒等。
(1)粉碎或研磨的目的:增大物質間的接觸面積,使反應或溶解
快速充分進行。
(2)水浸的目的:通過加水溶解,使可溶物進入溶液,與不溶物
通過過濾分離。
(3)酸浸的目的:通過加酸溶液,使物質(金屬、金屬氧化物、
難溶性堿或鹽)發生化學反應而溶解,與不溶物通過過濾分離。
(4)焙燒(或煅燒、灼燒)的目的:將物質氧化或者分解。
2. 實驗操作:常涉及的操作有過濾、蒸發、攪拌、結晶、蒸
餾、洗滌、干燥等。
(1)過濾:將不溶性固體與液體分離,過濾中用到的儀器有燒
杯、漏斗、玻璃棒等,玻璃棒的作用是 。
引流
(2)蒸發:得到單一溶液中的溶質,或溶解度隨溫度變化不大的
物質,蒸發中需用到的儀器有蒸發皿、酒精燈、鐵架臺、玻璃
棒等,玻璃棒的作用是 。
(3)攪拌:加快溶解或使物質充分反應。
攪拌,防止因局部過熱引起液滴飛濺
(4)結晶:使溶質結晶析出。
(5)洗滌:濾渣用水洗,洗去固體表面殘留溶液中的雜質;晶體
產品用該晶體的飽和溶液洗滌。判斷濾渣是否洗滌干凈的方
法:取少量最后一次的洗滌液,檢驗洗滌液中是否含有溶液中
的溶質。
3. 根據信息書寫化學方程式。
(1)辨箭頭判斷反應物和生成物。
(2)根據元素守恒與反應規律,判斷沒有給出的其他反應物或生
成物。
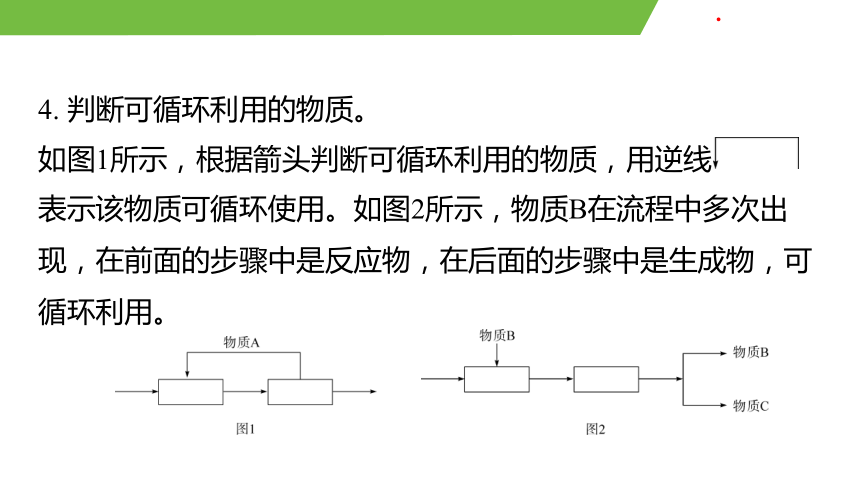
4. 判斷可循環利用的物質。
如圖1所示,根據箭頭判斷可循環利用的物質,用逆線
表示該物質可循環使用。如圖2所示,物質B在流程中多次出
現,在前面的步驟中是反應物,在后面的步驟中是生成物,可
循環利用。
5. 加入試劑的作用或目的。
從加入試劑的目的、反應的產物入手進行分析,但一定要考慮
是否會引入新的雜質。
(1)加入過量試劑的作用:①完全除去某物質;②使某物質完全
轉化為另一種物質。
(2)通入保護氣(如氮氣、氬氣等)的作用:隔絕空氣,防止生成
物被氧化或防止可燃性氣體發生爆炸。
6. 工藝流程的評價。
(1)科學性:是否能達到目的,即雜質是否完全除去,是否引入
新雜質。
(2)安全性:盡量選擇較溫和的反應條件,避免高溫、高壓
等條件。
(3)環保性:是否符合“綠色化學”理念,排放物是否無害
化處理。
(4)經濟性:原料廉價易得,產率或原料的利用率高。
專題精練
類型一 以物質作框
1. (2024·長沙)《周禮·考工記》中記載,古人曾在草木灰(含
K2CO3)的水溶液中加入貝殼燒成的灰(主要成分為CaO),利用
生成物中能夠去污的成分來清洗絲帛。為了得到該去污液,某
興趣小組同學在老師的指導下設計了如圖3實驗流程。回答下
列問題:
(1)操作Ⅰ的名稱為 。
(2)該流程中涉及所有的基本反應類型有分解反應、 。
過濾
化合反應、復分解反應
(3)該去污液能清洗絲帛。請你根據流程推測,該去污液中所含溶質的可能組成為
(用化學式表示)。
KOH;KOH、K2CO3;KOH、Ca(OH)2
2. (2024·煙臺)電動汽車的興起對金屬鎂和碳酸鋰(Li2CO3)的需求增大。以鹽湖鹵水(主要成分是MgCl2、NaCl、LiCl)為原料,制備金屬鎂和碳酸鋰的主要物質轉化流程如圖4:
資料:①碳酸鈉能與氯化鎂發生復分解反應。②部分物質的溶解度如下表。
物質 Li2CO3 MgCO3 LiOH LiCl MgCl2 Mg(OH)2
20℃時溶解度/g 1.32 0.039 12.8 77 54.8 難溶
(1)為避免引入新雜質,過程Ⅰ中加入的適量物質X是 。
(2)制鎂過程中發生中和反應的化學方程式是 。
(3)過程Ⅱ的目的是濃縮含鋰溶液。這個過程中,氯化鈉的結晶方法是 (選填“蒸發結晶”或“降溫結晶”)。
氫氧化鈉溶液
Mg(OH)2+2HCl MgCl2+2H2O
蒸發結晶
(4)過程Ⅲ發生了復分解反應,其反應的化學方程式是 .
。
(5)用鹽湖鹵水制取碳酸鋰,要先除去鹵水中的氯化鎂,其原因是 . 。
2LiCl+Na2CO3
防止MgCl2與
Na2CO3反應生成MgCO3沉淀,導致制得的Li2CO3不純(合理即可)
Li2CO3↓+2NaCl
類型二 以操作名稱作框
3. (2024·湖南)醬油是我國傳統調味品之一,已有3 000多年歷史。天然曬露法是傳統的老法醬油的生產方法。以初夏開始制作為例,主要流程如圖5:
回答下列問題:
(1)“發酵”過程中,所取缸內樣品呈 (選填酸”“中”或“堿”)性。
(2)“壓榨”與化學基本實驗操作中的 (填操作名稱)有相似之處。
酸
過濾
(3)下列有關說法正確的是 (多選,填字母)。
a.“浸泡”目的是泡漲大豆,并除去雜物
b.鐵強化醬油中的“鐵”可以預防佝僂病
c.天然曬露法得到成品的時間會受天氣影響
ac
4. (2024·成都)皮蛋是成渝等地人們喜愛的食品,制作流程如圖6。
資料:1.草木灰(含K2CO3)中常含有砂石和未燃盡的秸稈等固體。
2. 堿,有澀味,可與蛋白質作用,使其凝固。
(1)選料:“過篩”的目的是 。
除去砂石和未燃盡的秸稈等顆粒較大的固體
回答下列問題。
(2)調漿:調漿過程發生的復分解反應的化學方程式為 .
,料漿浸出液中一定含有的陰離子有 (填離子符號)。
Na2CO3+Ca(OH)2
CaCO3↓+2NaOH(或K2CO3+Ca(OH)2 CaCO3↓+2KOH)
OH-和Cl-
(3)裹泥:裹泥時,不慎皮膚接觸料漿,處理方法為 。
(4)封存:需要“密封”的主要原因是減少水分蒸發和
。
用大量清水沖洗
減少空氣中二氧化碳
與皮蛋表面的堿反應,避免皮蛋制作失敗(合理即可)
(5)食用皮蛋時加醋能去除澀味的原因是 。
醋能與皮蛋中的堿性物質發生反應
5. (2024·長沙模擬)蛇紋石礦主要由MgO、Fe2O3、Al2O3、SiO2組成。由蛇紋石制取堿式碳酸鎂的實驗步驟如圖7所示。
查閱資料:幾種物質沉淀和溶解時的pH如圖8所示。
(1)寫出“溶解”步驟中加入HCl得到黃色溶液發生反應的化學方程式: 。
(2)Ca(OH)2不能過量,若Ca(OH)2過量,可能導致 .
,造成產品不純、產率下降。
。
Fe2O3+6HCl 2FeCl3+3H2O
Al(OH)3沉淀溶解,鎂離子
與氫氧根離子反應產生Mg(OH)2沉淀
(3)進行環節Ⅰ時,需控制溶液pH=6~7,此時原溶液中沒有沉淀的金屬陽離子是
(寫離子符號)。
Mg2+
(4)根據上述制取堿式碳酸鎂的工藝流程的信息,請設計一個用某石灰石(成分只考慮碳酸鈣和二氧化硅)提純得到純凈的碳酸鈣的簡單的實驗方案:取少量該石灰石樣品,
。
加入足量的稀鹽酸,過濾,向濾液中加入適量碳酸鈉溶液,再過濾、洗滌、
干燥就得到了純凈的碳酸鈣
6. (2024·湖北)某工廠在粗鹽的提純過程中產生了大量的“鹽泥”[主要成分為Mg(OH)2、BaSO4和NaCl]。利用“鹽泥”制備硫酸鎂晶體的工藝流程如圖9所示。
類型三 以設備作框
溫度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22.0 33.7 44.5 54.6 55.8
已知:NaCl和MgSO4兩種物質在不同溫度時的溶解度如表。
(1)20℃時,NaCl的溶解度為 g。
(2)“反應器”中反應的化學方程式為 。
36.0
Mg(OH)2+H2SO4MgSO4+2H2O
(3)“過濾器1”產生的“濾渣”為 。
(4)“結晶槽”中獲得硫酸鎂晶體的方法是 結晶。
BaSO4(或硫酸鋇)
冷卻(或降溫)
溫度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22.0 33.7 44.5 54.6 55.8
(5)從結晶槽中獲得的硫酸鎂晶體表面附著有雜質,需用試劑洗去。為避免晶體損失,最適宜的洗滌試劑是 。
飽和硫酸鎂溶液(或飽和MgSO4溶液)
7. (2024·長沙模擬)高錳酸鉀(KMnO4)是一類重要的化學品,已廣泛應用于醫學、工業等領域。目前,高錳酸鉀生產仍采用固相焙燒法,其制備工藝主要為:將軟錳礦(主要成分為MnO2)與堿(KOH)和氧化劑(O2)混合后共熔制得K2MnO4,再經電解、結晶、分離、干燥等工序制得高錳酸鉀。其主要工藝流程如圖10:(熔融物指固體物質加熱熔化后呈現的液態物質)
請回答下列問題:
(1)步驟Ⅰ“混合加熱”中發生的變化主要是 (選填“物理”或“化學”)變化。
(2)該流程中,可以循環利用的物質是 (填化學式)。
物理
KOH
(3)下列有關該流程的相關分析中,正確的是 (填字母)。
A. 步驟Ⅱ“氧化反應”中,空氣中的氧氣參與了反應
B. 步驟Ⅲ“電解”中,只有錳元素的化合價發生變化
C. 產品經“干燥”工序時溫度不宜過高
D. 為使生產流程持續進行,需要適時另外補充KOH
ACD
展開更多......
收起↑
 資源預覽
資源預覽