資源簡介
資源簡介
(共58張PPT)
第一章 化學反應的熱效應
第一節 反應熱
第1課時 反應熱 焓變
一 反應熱及其測定
01
體系
環境
釋放
吸收
1.體系(系統)與環境
被研究的物質及發生的反應等看作一個反應體系,簡稱 (又稱系統);與體系相互影響的其他部分看作 。
2.反應熱
在等溫條件下,化學反應體系向環境 或從環境 的熱量,稱為化學反應的熱效應,簡稱反應熱。
溫度變化
比熱容
鹽酸完全被中和
3.中和反應反應熱的測定(以稀鹽酸與稀NaOH溶液反應為例)
(1)測定原理
通過簡易量熱計測得體系在反應前后的 ,再利用有關物質的 等來計算反應熱(注:為了保證 ,采用稍過量的NaOH溶液)。
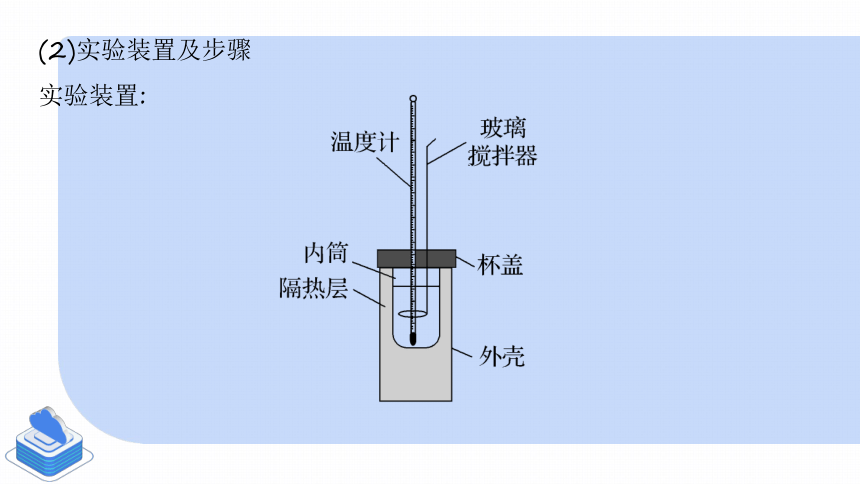
(2)實驗裝置及步驟
實驗裝置:
最高
實驗步驟:
①測量反應物的溫度,記錄反應前體系的溫度為t1(℃)(取鹽酸溫度和NaOH溶液溫度的平均值),記錄所使用酸的質量為m1 g,所使用堿的質量為m2 g;
②測量反應后體系的溫度,記錄反應后體系的 溫度為t2(℃);
③重復步驟①至步驟②兩次;
57.3
④數據處理:取三次測量所得溫度差的平均值進行計算(為方便計算,可以近似地認為實驗所用酸、堿稀溶液的密度、比熱容與水的相同,并忽略量熱計的比熱容),反應后溶液的比熱容c=4.18 J/(g·℃),則生成1 mol H2O時放出的熱量為 kJ。
大量實驗測得,在25 ℃和101 kPa下,強酸的稀溶液與強堿的稀溶液發生中和反應生成1 mol H2O時,放出 kJ的熱量。
×
×
×
×
×
1.中和熱的測定實驗中,可分多次把氫氧化鈉溶液倒入盛有稀鹽酸的小燒杯中。( )
2.玻璃攪拌器可用鐵絲制作的攪拌器代替。( )
3.在25 ℃和101 kPa下,1 mol稀硫酸與足量NaOH溶液反應放出57.3 kJ熱量。( )
4.用不同的酸和不同的堿進行實驗,測定所得中和熱的數值一定不相同。( )
5.為減小溫度測定時的誤差,酸堿混合后立即測定初始溫度(t1),當溫度達到最大值時,立即測定終止溫度(t2)。( )
1.大量的實驗測得,298 K和101 kPa下,強酸和強堿稀溶液發生中和反應生成1 mol液態水時,放出57.3 kJ的熱量。測得的數據小于57.3,分析產生誤差的可能原因是什么
提示:
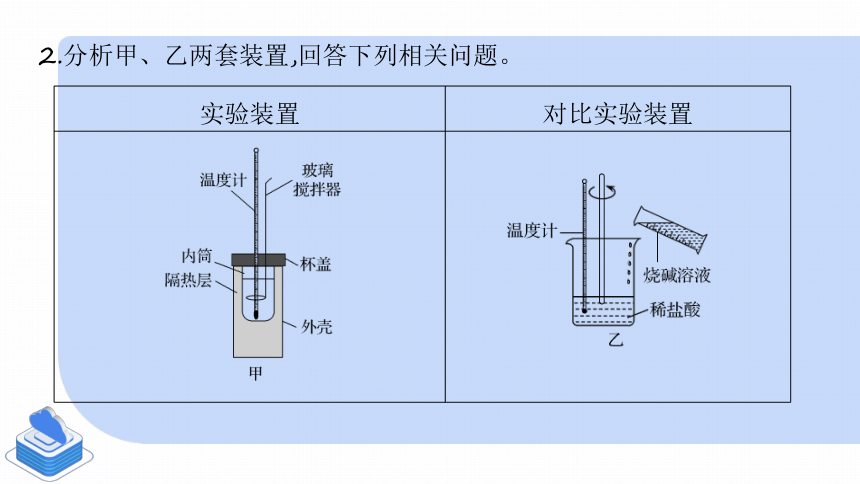
實驗裝置 對比實驗裝置
2.分析甲、乙兩套裝置,回答下列相關問題。
(1)用50 mL 0.5 mol·L-1的鹽酸與50 mL 0.55 mol·L-1的NaOH溶液在如圖所示的裝置中分別進行中和反應反應熱的測定,測定的結果是否相同 為什么
提示:(1)不相同。因為乙裝置中沒有保溫措施,會導致反應產生的熱量散失,使反應前后溫度變化量的測量值不準確。
(2)對比上述兩套實驗裝置,你認為在中和反應反應熱的測定中必須要注意什么問題
提示: (2)中和反應反應熱的測定過程中必須注意的問題是保溫。
(3)本實驗中常用稍過量的NaOH溶液,原因是保證鹽酸能夠完全被中和。如果在反應中因為有放熱現象,而造成少量HCl揮發,則測得的中和熱的值偏大還是偏小 為什么
提示: (3)偏小。因為有放熱現象導致少量HCl在反應中揮發,減少了參與反應的HCl的量,故測得的中和熱的值會偏小。
D
1.如圖是某興趣小組組裝的中和熱測定裝置,分別取40 mL 0.50 mol·L-1鹽酸與40 mL 0.55 mol·L-1氫氧化鈉溶液進行中和熱的測定。下列說法錯誤的是( )
A.稍過量的氫氧化鈉是為了確保鹽酸完全反應
B.儀器A的名稱是玻璃攪拌器
C.在測定中和熱的每次實驗中,至少需要測定并記
錄3次溫度
D.用濃硫酸和濃Ba(OH)2溶液代替鹽酸和氫氧化鈉溶液,其結果也是相同的
D
2.下列反應中放出57.3 kJ熱量的是( )
A.1 mol稀H2SO4與足量NaOH溶液反應
B.稀鹽酸與氨水反應生成1 mol H2O(l)
C.濃H2SO4與稀NaOH溶液反應生成1 mol H2O(l)
D.稀鹽酸與稀氫氧化鋇溶液反應生成1 mol H2O(l)
二 反應熱與焓變
02
溫度
壓強
物質的聚集狀態
內能
ΔH
kJ/mol
kJ·mol-1
H(生成物)-H(反應物)
1.焓
(1)內能:體系內物質的各種能量的總和,受 、 和
等影響。
(2)焓:與物質 有關的物理量,符號:H。
2.焓變
(1)含義:在等壓條件下進行的化學反應(嚴格地說,對反應體系做功還有限定,中學階段一般不考慮),其反應熱等于反應的焓變,用符號 表示,常用單位是 (或 )。ΔH= 。
放熱反應 吸熱反應
反應體系放熱,其焓減小,ΔH為負值 反應體系吸熱,其焓增大,ΔH為正值
(2)焓變與放熱反應、吸熱反應的關系
3.從微觀角度討論反應熱的實質
(1)實例分析:以H2(g)+Cl2(g)===2HCl(g)反應的能量變化為例。
436
243
862
-183 kJ/mol
化學鍵 反應中能量變化
斷裂或形成1 mol化學鍵的能量變化 斷裂或形成化學鍵的總能量變化
H—H 吸收 kJ 共吸收679 kJ
Cl—Cl 吸收 kJ
H—Cl 放出431 kJ 共放出 kJ
結論 H2(g)+Cl2(g)===2HCl(g)的反應熱ΔH=
E1>E2 ΔH>0 反應
E1
吸熱
放熱
(2)反應熱(ΔH)的實質
ΔH= 。
×
√
√
√
1.物質發生化學反應一定伴隨著能量變化,伴隨能量變化的物質變化一定都是化學變化。( )
2.放熱反應有的需要加熱才能進行,有些吸熱反應常溫下即可進行。
( )
3.焓變的大小與物質的種類、數量、聚集狀態以及溫度、壓強等有關。
( )
4.比較熱量的多少是比較絕對值,而比較焓變的大小則是比較代數值(包含正負號)。( )
D
1.下列反應中生成物的總能量大于反應物的總能量的是( )
A.氧化鈣溶于水
B.乙醇燃燒
C.鋁粉與氧化鐵粉末反應
D.碳酸鈣受熱分解
符合題目要求的應該是吸熱反應,A、B、C均為放熱反應,D為吸熱反應,故選D。
A
2.已知化學反應A2(g)+B2(g) ===2AB(g)的能量變化如圖所示,判斷下列說法正確的是( )
A.該反應的ΔH=+(a-b) kJ·mol-1
B.1 mol A2(g)與1 mol B2(g)反應生成2 mol AB(g),
吸收b kJ能量
C.該反應中反應物的總能量高于生成物的總能量
D.斷裂1 mol A2(g)中A—A和1 mol B2(g)中B—B,放出a kJ能量
由圖可知,反應物的總能量低于生成物的總能量,該反應為吸熱反應,即ΔH=+(a-b) kJ·mol-1,故A正確、C錯誤;1 mol A2(g)與1 mol B2(g)反應生成
2 mol AB(g)吸收的能量為(a-b) kJ,故B錯誤;斷鍵需要吸收能量,故斷裂
1 mol A2(g)中A—A和1 mol B2(g)中B—B,吸收a kJ能量,故D錯誤。
共價鍵 H—H F—F H—F H—Cl H—I
E/(kJ·mol-1) 436 157 568 431 298
D
3.常溫下,1 mol化學鍵形成氣態原子所需要的能量用E表示。結合表中信息,判斷下列說法不正確的是( )
A.431 kJ·mol-1>E(H—Br)>298 kJ·mol-1
B.表中最穩定的共價鍵是H—F
C.H2(g)―→2H(g) ΔH=+436 kJ·mol-1
D.H2(g)+F2(g) ===2HF(g) ΔH=-25 kJ·mol-1
由題表中數據知,氟、氯、碘的氫化物鍵能逐漸減小,故431 kJ·mol-1
>E(H—Br)>298 kJ·mol-1,A項正確;題表中共價鍵H—F的鍵能最大,即共價鍵H—F最穩定,B項正確;共價鍵斷裂要吸收能量,即H2(g)―→2H(g) ΔH=+436 kJ·mol-1,C項正確;反應H2(g)+F2(g) ===2HF(g)的反應熱ΔH=(436+157-2×568) kJ·mol-1=-543 kJ·mol-1,D項不正確。
焓變的兩種計算方法
(1)根據物質具有的焓計算:
ΔH=H(總生成物)-H(總反應物)。
(2)根據化學鍵鍵能來計算:
ΔH=反應物的鍵能總和-生成物的鍵能總和=反應物斷鍵吸收的總能量-生成物成鍵釋放的總能量。
2
3
4
5
6
7
8
1
9
10
A
本節訓練
題組一 反應熱及其測定
1.下列變化中屬于吸熱反應的是( )
①液態水汽化 ②CaCO3高溫分解 ③CO2(g)+C(s)2CO(g)
④Ba(OH)2·8H2O與固體NH4Cl混合 ⑤C(s)+H2O(g)CO(g)+H2(g) ⑥Al與鹽酸反應
A.②③④⑤ B.①②③④⑤
C.①②④⑥ D.①④⑤
2
3
4
5
6
7
8
1
9
10
①液態水汽化為物理變化,不是吸熱反應,也不是放熱反應;②CaCO3高溫分解屬于分解反應,為吸熱反應;③CO2(g)+C(s)2CO(g)、
⑤C(s)+H2O(g)CO(g)+H2(g)屬于以C為還原劑的吸熱反應;
④Ba(OH)2·8H2O與固體NH4Cl混合,為吸熱反應;⑥Al與鹽酸反應為放熱反應。
2
3
4
5
6
7
8
1
9
10
C
2.下列有關中和反應的反應熱測定實驗的說法正確的是( )
A.取用等物質的量的鹽酸和氫氧化鈉溶液發生反應
B.可以用鐵片蓋住燒杯口
C.溫度計每次用后,要用水沖洗干凈
D.記錄不再變化的溫度為終止溫度
2
3
4
5
6
7
8
1
9
10
在中和反應的反應熱測定實驗中,為保證一方完全反應,往往需要另一方過量,則不能取用等物質的量的鹽酸和氫氧化鈉溶液發生反應,故A錯誤;金屬的導熱性好,易造成熱量散失,應該用硬紙板蓋住燒杯口,故B錯誤;用溫度計測完酸(或堿)溶液的溫度后,要用水沖洗干凈并擦干,將溫度計冷卻回零后,再測定堿(或酸)溶液的溫度,故C正確;實驗記錄的最高溫度為終止溫度,而不是不再變化的溫度,故D錯誤。
2
3
4
5
6
7
8
1
9
10
3.在25 ℃和101 kPa下,我們將強酸的稀溶液與強堿的稀溶液發生中和反應生成1 mol H2O時所釋放的熱量稱為中和熱。已知在25 ℃、101 kPa下,稀溶液中強酸和強堿每生成1 mol水放出57.3 kJ的熱量。如圖是某化學小組組裝的中和熱簡易測定裝置,回答有關問題。
2
3
4
5
6
7
8
1
9
10
11.46
(1)用0.1 mol Ba(OH)2配成稀溶液與足量稀硝酸反應,能放出 kJ熱量。
(1)根據中和熱的含義:H+(aq)+OH-(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1,所以0.1 mol Ba(OH)2配成的稀溶液與足量稀硝酸反應時生成0.2 mol H2O(l),放出的熱量為11.46 kJ。
2
3
4
5
6
7
8
1
9
10
攪拌,使溶液充分混合
(2)如圖裝置中儀器A的作用是_________________________________。
(2)由實驗裝置圖知,A為玻璃攪拌器,作用是攪拌,使溶液充分混合。
2
3
4
5
6
7
8
1
9
10
實驗中不可避免地有少量熱量損失
(3)若通過實驗測定中和熱的ΔH,其結果常常大于-57.3 kJ·mol-1,其原因可能是 。
(3)在測定中和熱的實驗中,減少熱量損失是實驗的關鍵,而在實驗中會不可避免地有少量熱量損失,導致測得的數值常常大于-57.3 kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
偏小
(4)用相同濃度和體積的氨水(NH3·H2O)代替Ba(OH)2溶液進行上述實驗,測得中和熱的數值會 (填“偏大”“偏小”或“無影響”)。
(4)用氨水代替Ba(OH)2溶液,會使測得的中和熱數值偏小,因為氨水(NH3·H2O)是弱堿,電離時需吸收熱量。
2
3
4
5
6
7
8
1
9
10
D
題組二 反應熱與焓變
4.下列關于反應熱與焓變的理解正確的是( )
A.任何條件下,化學反應的焓變都等于反應熱
B.放熱反應的ΔH>0,吸熱反應的ΔH<0
C.所有化學反應的反應熱都可以通過實驗直接測量
D.生成物的總焓大于反應物的總焓時,ΔH>0
2
3
4
5
6
7
8
1
9
10
只有在恒壓條件下進行的化學反應,反應熱才等于焓變,A錯誤;放熱反應的ΔH<0,吸熱反應的ΔH>0,B錯誤;有些化學反應的反應熱不能通過實驗直接測量,C錯誤;生成物的總焓大于反應物的總焓時,說明反應吸熱,D正確。
2
3
4
5
6
7
8
1
9
10
B
5.已知:C(石墨,s) ===C(金剛石,s) ΔH>0;
P(白磷,s) === P(紅磷,s) ΔH<0。
根據上述信息推論正確的是( )
A.前者為放熱反應
B.紅磷的能量比白磷低
C.金剛石比石墨穩定
D.上述變化都為物理變化
2
3
4
5
6
7
8
1
9
10
依據熱化學方程式可知石墨轉化為金剛石是吸熱反應,A錯誤;白磷轉化成紅磷是放熱反應,則紅磷的能量低于白磷,B正確;石墨轉化為金剛石是吸熱反應,則金剛石的能量高于石墨,說明金剛石不如石墨穩定,C錯誤;同素異形體之間的轉化是化學變化,不是物理變化,D錯誤。
2
3
4
5
6
7
8
1
9
10
6.下列圖像分別表示有關反應的反應過程與能量變化的關系:
2
3
4
5
6
7
8
1
9
10
A
據此判斷下列說法正確的是( )
A.石墨轉變為金剛石是吸熱反應
B.白磷比紅磷穩定
C.①S(g)+O2(g) ===SO2(g);②S(s)+O2(g) ===SO2(g),放出熱量:①<②
D.CO(g)+H2O(g) ===CO2(g)+H2 (g),該反應為吸熱反應
2
3
4
5
6
7
8
1
9
10
由題圖可知,金剛石所具有的能量比石墨高,因此石墨轉變為金剛石是吸熱反應,故A項正確;由題圖可知,紅磷所具有的能量比白磷低,因此紅磷更穩定,故B項錯誤;對同一種物質而言,氣態時所具有的能量比固態時所具有的能量高,即S(g)所具有的能量大于S(s),放出熱量應該為①>②,故C項錯誤;由題圖可知,CO(g)和H2O(g)所具有的總能量高于CO2(g)和 H2 (g)所具有的總能量,因此反應CO(g)+H2O(g) ===CO2(g)+ H2(g)為放熱反應,故D項錯誤。
2
3
4
5
6
7
8
1
9
10
7.H2與O2、F2均能發生反應,如圖為H2與F2發生反應生成HF過程中的能量變化示意圖。
2
3
4
5
6
7
8
1
9
10
吸收
放出
請回答下列問題:
(1)完成轉化Ⅰ、Ⅱ (填“吸收”或“放出”,下同)能量,完成轉化Ⅲ
能量。
(1)斷裂化學鍵吸收能量,形成化學鍵釋放能量。Ⅰ、Ⅱ是斷裂化學鍵,因此是吸收能量,Ⅲ是形成化學鍵,因此是放出能量。
2
3
4
5
6
7
8
1
9
10
A
(2)H2和F2反應的能量變化圖可用 (填“A”或“B”)表示。
2
3
4
5
6
7
8
1
9
10
(2)由圖計算可知,H2和F2生成HF的反應為放熱反應,反應物的總能量大于生成物的總能量,故選項A正確。
2
3
4
5
6
7
8
1
9
10
化學
熱
(3)H2在O2中燃燒的過程主要是 能轉化為 能的過程。
(3)氫氣在氧氣中燃燒是放熱反應,主要是化學能轉化為熱能的過程。
2
3
4
5
6
7
8
1
9
10
化學鍵 鍵能/(kJ·mol-1)
H—H 436
N—H 391
N≡N 946
C
綜合強化
8.工業合成氨的反應為N2(g)+3H2(g) 2NH3(g),已知下列化學鍵的鍵能(斷裂或形成1 mol 化學鍵時所吸收或放出的能量):
下列說法正確的是( )
A.該反應為吸熱反應
B.該反應中反應物的總能量低于生成物的總能量
C.反應熱ΔH=-92 kJ·mol-1
D.生成1 mol NH3(g)放出92 kJ熱量
2
3
4
5
6
7
8
1
9
10
在反應N2(g)+3H2(g) 2NH3(g)中,1 mol N2(g)參加反應,斷鍵共吸熱946 kJ·mol-1+436 kJ·mol-1×3=2 254 kJ·mol-1,成鍵共放熱391 kJ·mol-1×6=2 346 kJ·mol-1,由于放出熱量>吸收熱量,故該反應放熱,放熱反應的反應物的總能量高于生成物的總能量,A、B項錯誤;1 mol N2(g)和3 mol H2(g)完全反應生成2 mol NH3(g)的反應熱為ΔH=-(2 346-2 254) kJ·mol-1=-92 kJ·mol-1,C項正確;由C項分析可知,生成2 mol NH3(g)時放出92 kJ熱量,則生成1 mol NH3(g)時放出的熱量為92 kJ×=46 kJ,D項錯誤。
2
3
4
5
6
7
8
1
9
10
9.化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量與新化學鍵形成時放出的能量不同引起的。如圖所示為N2(g)與O2(g)反應生成NO(g)的過程中的能量變化,下列說法中錯誤的是( )
2
3
4
5
6
7
8
1
9
10
A.1 mol N2(g)與1 mol O2(g)反應吸收的能量為180 kJ
B.1 mol N2(g)與1 mol O2(g)具有的總能量小于2 mol NO(g)具有的總能量
C.通常情況下,N2(g)與O2(g)混合不能直接生成NO(g)
D.數據不足,不能確定反應熱的大小
答案:D
2
3
4
5
6
7
8
1
9
10
ΔH=反應物斷裂化學鍵吸收的能量-生成物形成化學鍵放出的能量,
N2(g)+O2(g) ===2NO(g) ΔH=(946+498-2×632) kJ·mol-1=+180 kJ·mol-1,A正確、D錯誤;吸熱反應中反應物的總能量小于生成物的總能量,B正確;
N2(g)與O2(g)混合不能直接生成NO(g),需在放電或高溫的條件下反應才能發生,C正確。
2
3
4
5
6
7
8
1
9
10
10.50 mL 0.5 mol·L-1鹽酸與50 mL 0.55 mol·L-1 NaOH溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱
(在25 ℃和101 kPa下,強酸的稀溶液與強堿的稀溶液發生中和反應生成
1 mol H2O時所釋放的熱量稱為中和熱)。
2
3
4
5
6
7
8
1
9
10
玻璃攪拌器
回答下列問題:
(1)從實驗裝置上看,圖中缺少的一種玻璃用品是 。
(1)在測定中和熱時,需使用玻璃攪拌器攪拌,加快反應速率。
2
3
4
5
6
7
8
1
9
10
減少實驗過程中的熱量損失
偏大
(2)燒杯間填滿碎紙片的作用是________________________________。
若大燒杯上不蓋硬紙板,求得的ΔH (填“偏大”“偏小”或“無影響”) 。
(2)實驗中在燒杯間填滿碎紙片和在大燒杯上蓋上硬紙板目的都是盡可能減少熱量損失,否則會使測得的ΔH偏大。
2
3
4
5
6
7
8
1
9
10
不相等
相等
(3)實驗中若改用60 mL 0.5 mol·L-1鹽酸與50 mL 0.55 mol·L-1 NaOH溶液進行反應,與上述實驗相比,所放出的熱量 (填“相等”或“不相等”,下同),所測得的中和熱 。
(3)實驗中反應的酸堿含量增多,放出的熱量也增多,但中和熱不變,因為中和熱是指在稀溶液中,強酸與強堿發生中和反應生成1 mol H2O(l)時放出的熱量,與強酸強堿的用量無關。
展開更多......
收起↑
 資源預覽
資源預覽