資源簡介
資源簡介
(共31張PPT)
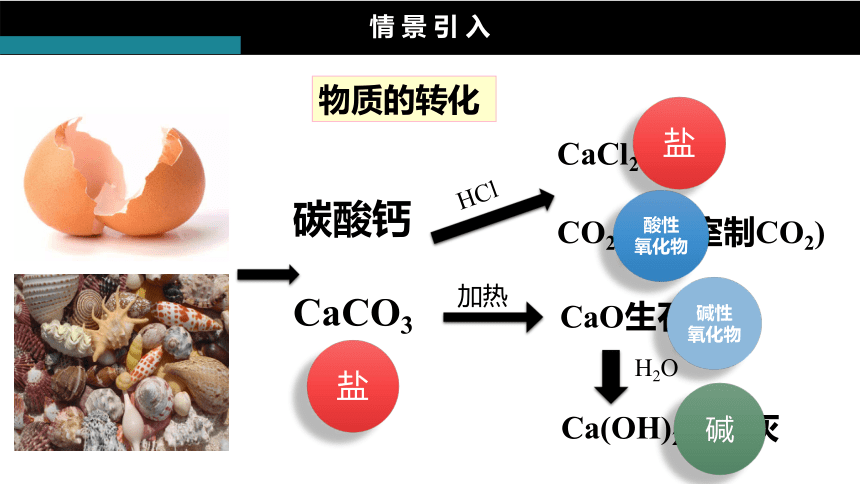
物質(zhì)的轉(zhuǎn)化
第3課時(shí)
第一節(jié) 物質(zhì)的分類及轉(zhuǎn)化
[學(xué)習(xí)目標(biāo)]
1.熟知酸、堿、鹽的性質(zhì),會(huì)寫相關(guān)反應(yīng)的化學(xué)方程式,并判斷其反應(yīng)類型。
2.認(rèn)識(shí)同類物質(zhì)具有相似性,學(xué)會(huì)分析研究物質(zhì)性質(zhì)與相互轉(zhuǎn)化的方法。
[重點(diǎn)難點(diǎn)]
1.利用酸、堿、鹽的通性分析物質(zhì)之間的轉(zhuǎn)化。
2.根據(jù)物質(zhì)類別預(yù)測新物質(zhì)的性質(zhì)。
碳酸鈣
CaCO3
HCl
CaCl2
CO2(實(shí)驗(yàn)室制CO2)
加熱
CaO生石灰
H2O
Ca(OH)2熟石灰
鹽
鹽
酸性
氧化物
堿性
氧化物
堿
物質(zhì)的轉(zhuǎn)化
情 景 引 入
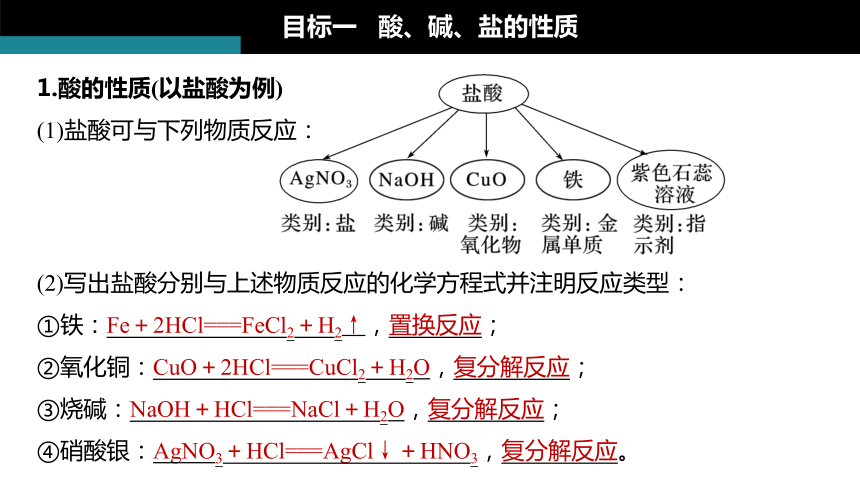
1.酸的性質(zhì)(以鹽酸為例)
(1)鹽酸可與下列物質(zhì)反應(yīng):
目標(biāo)一 酸、堿、鹽的性質(zhì)
(2)寫出鹽酸分別與上述物質(zhì)反應(yīng)的化學(xué)方程式并注明反應(yīng)類型:
①鐵:Fe+2HCl===FeCl2+H2↑,置換反應(yīng);
②氧化銅:CuO+2HCl===CuCl2+H2O,復(fù)分解反應(yīng);
③燒堿:NaOH+HCl===NaCl+H2O,復(fù)分解反應(yīng);
④硝酸銀:AgNO3+HCl===AgCl↓+HNO3,復(fù)分解反應(yīng)。
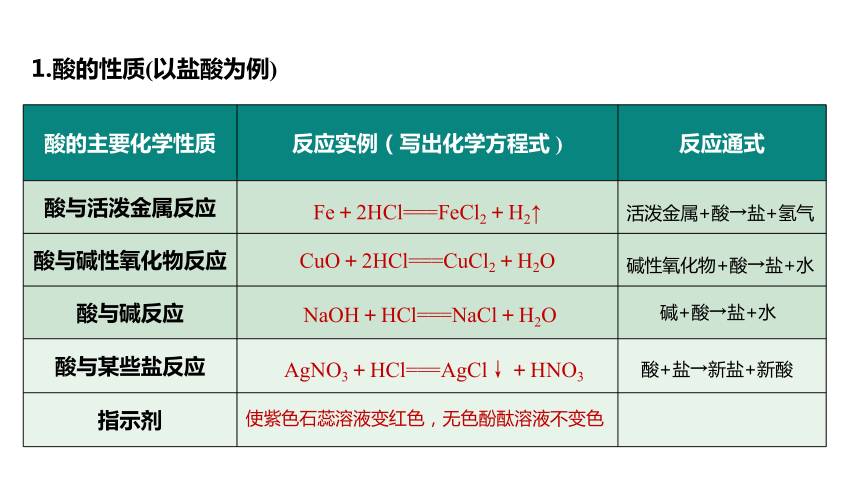
酸的主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
酸與活潑金屬反應(yīng) Fe+2HCl===FeCl2+H2↑
酸與堿性氧化物反應(yīng) CuO+2HCl===CuCl2+H2O
酸與堿反應(yīng)
酸與某些鹽反應(yīng)
指示劑
堿性氧化物+酸→鹽+水
使紫色石蕊溶液變紅色,無色酚酞溶液不變色
活潑金屬+酸→鹽+氫氣
NaOH+HCl===NaCl+H2O
堿+酸→鹽+水
AgNO3+HCl===AgCl↓+HNO3
酸+鹽→新鹽+新酸
1.酸的性質(zhì)(以鹽酸為例)
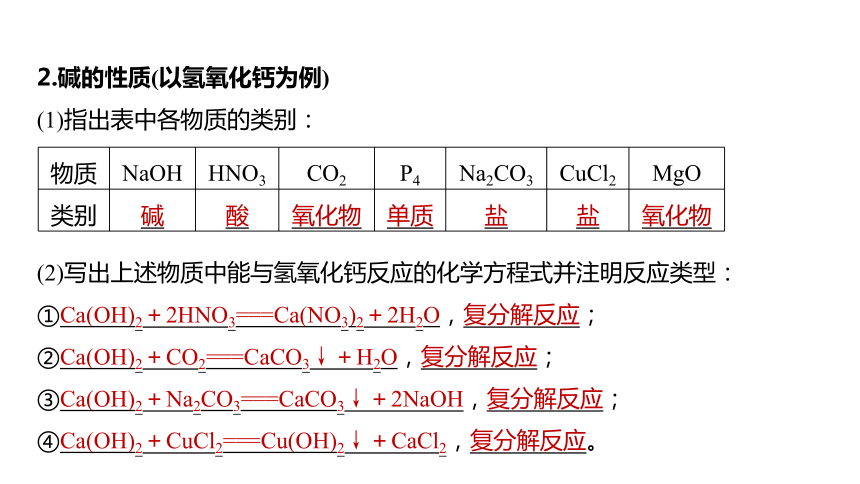
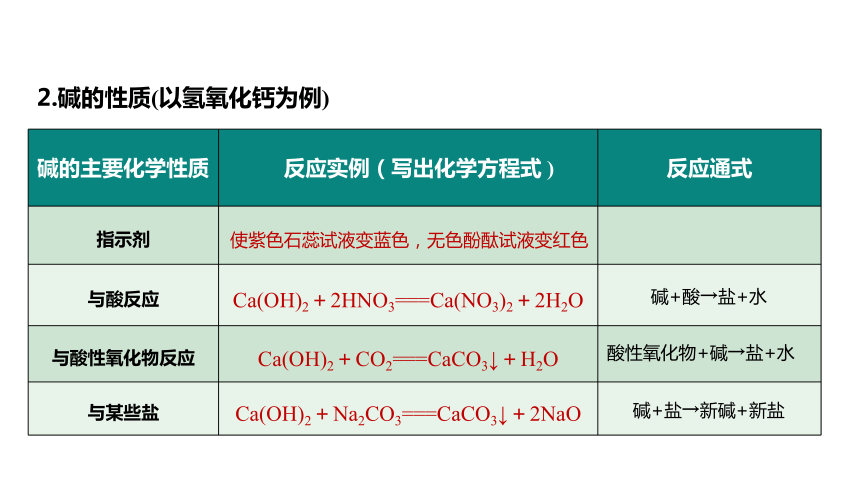
2.堿的性質(zhì)(以氫氧化鈣為例)
(1)指出表中各物質(zhì)的類別:
物質(zhì) NaOH HNO3 CO2 P4 Na2CO3 CuCl2 MgO
類別 堿 酸 氧化物 單質(zhì) 鹽 鹽 氧化物
(2)寫出上述物質(zhì)中能與氫氧化鈣反應(yīng)的化學(xué)方程式并注明反應(yīng)類型:
①Ca(OH)2+2HNO3===Ca(NO3)2+2H2O,復(fù)分解反應(yīng);
②Ca(OH)2+CO2===CaCO3↓+H2O,復(fù)分解反應(yīng);
③Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,復(fù)分解反應(yīng);
④Ca(OH)2+CuCl2===Cu(OH)2↓+CaCl2,復(fù)分解反應(yīng)。
堿的主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
指示劑
與酸反應(yīng) Ca(OH)2+2HNO3===Ca(NO3)2+2H2O
與酸性氧化物反應(yīng) Ca(OH)2+CO2===CaCO3↓+H2O
與某些鹽 Ca(OH)2+Na2CO3===CaCO3↓+2NaO
使紫色石蕊試液變藍(lán)色,無色酚酞試液變紅色
酸性氧化物+堿→鹽+水
堿+鹽→新堿+新鹽
堿+酸→鹽+水
2.堿的性質(zhì)(以氫氧化鈣為例)
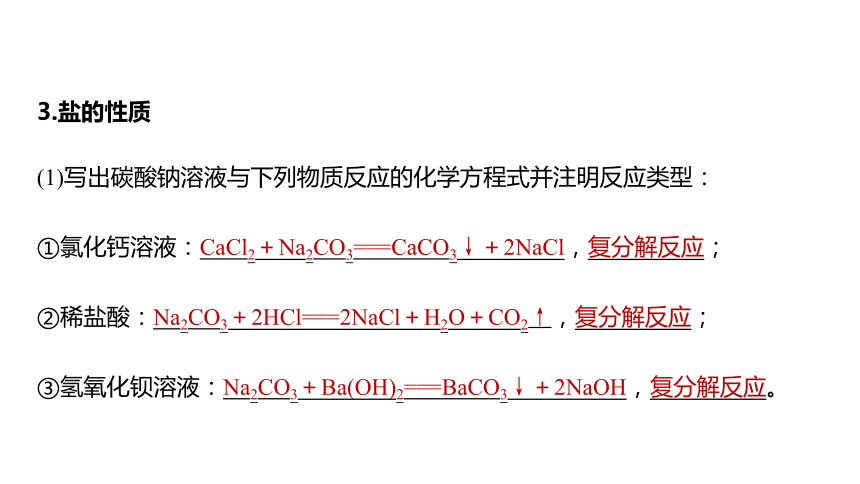
3.鹽的性質(zhì)
(1)寫出碳酸鈉溶液與下列物質(zhì)反應(yīng)的化學(xué)方程式并注明反應(yīng)類型:
①氯化鈣溶液:CaCl2+Na2CO3===CaCO3↓+2NaCl,復(fù)分解反應(yīng);
②稀鹽酸:Na2CO3+2HCl===2NaCl+H2O+CO2↑,復(fù)分解反應(yīng);
③氫氧化鋇溶液:Na2CO3+Ba(OH)2===BaCO3↓+2NaOH,復(fù)分解反應(yīng)。
3.鹽的性質(zhì)
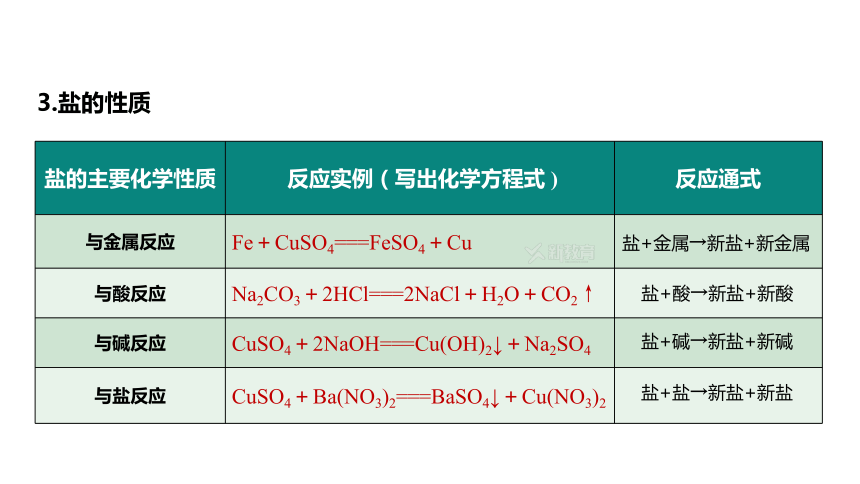
(2)寫出硫酸銅溶液與下列物質(zhì)反應(yīng)的化學(xué)方程式并注明反應(yīng)類型:
①硝酸鋇溶液:CuSO4+Ba(NO3)2===BaSO4↓+Cu(NO3)2,復(fù)分解反應(yīng);
②氫氧化鈉溶液:CuSO4+2NaOH===Cu(OH)2↓+Na2SO4,復(fù)分解反應(yīng);
③單質(zhì)鐵:Fe+CuSO4===FeSO4+Cu,置換反應(yīng)。
鹽的主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
與金屬反應(yīng) Fe+CuSO4===FeSO4+Cu
與酸反應(yīng) Na2CO3+2HCl===2NaCl+H2O+CO2↑
與堿反應(yīng) CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
與鹽反應(yīng) CuSO4+Ba(NO3)2===BaSO4↓+Cu(NO3)2
鹽+酸→新鹽+新酸
鹽+堿→新鹽+新堿
鹽+鹽→新鹽+新鹽
鹽+金屬→新鹽+新金屬
3.鹽的性質(zhì)
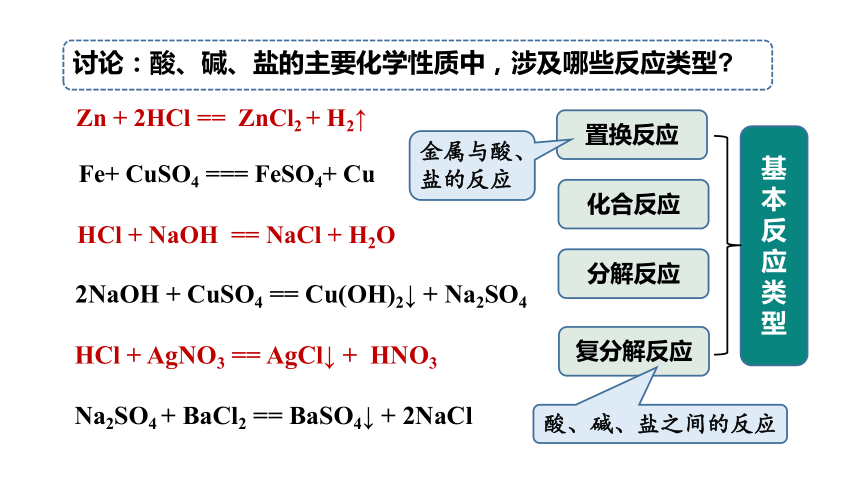
討論:酸、堿、鹽的主要化學(xué)性質(zhì)中,涉及哪些反應(yīng)類型
Zn + 2HCl == ZnCl2 + H2↑
HCl + NaOH == NaCl + H2O
HCl + AgNO3 == AgCl↓ + HNO3
2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
置換反應(yīng)
復(fù)分解反應(yīng)
化合反應(yīng)
分解反應(yīng)
Fe+ CuSO4 === FeSO4+ Cu
基本反應(yīng)類型
酸、堿、鹽之間的反應(yīng)
金屬與酸、鹽的反應(yīng)
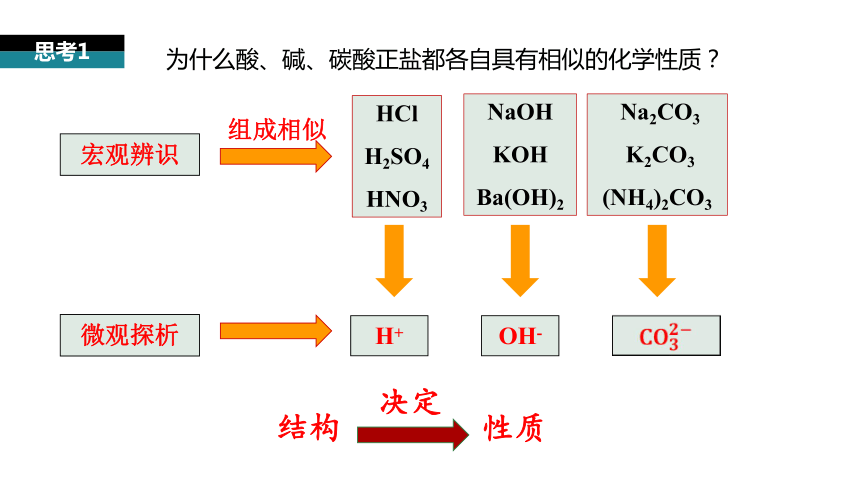
宏觀辨識(shí)
組成相似
微觀探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
結(jié)構(gòu)
決定
性質(zhì)
思考1
為什么酸、堿、碳酸正鹽都各自具有相似的化學(xué)性質(zhì)?
思考2
基于物質(zhì)分類尋找具有相同或相似性質(zhì)的物質(zhì):SO2和CO2同為酸性氧化物,試根據(jù)酸性氧化物具有的通性(或CO2的性質(zhì)),回答下列問題:
(1)請寫出SO2與生石灰反應(yīng)的化學(xué)方程式: 。
(2)SO2的實(shí)驗(yàn)室制法與CO2的實(shí)驗(yàn)室制法具有許多相似之處,請寫出H2SO4和Na2SO3反應(yīng)制取SO2的化學(xué)方程式: 。
(3)將足量的SO2通入澄清石灰水中的現(xiàn)象是 。
SO2+CaO===CaSO3
H2SO4+Na2SO3===Na2SO4+SO2↑+H2O
溶液先變渾濁,后變澄清
練習(xí)1
在一定條件下,跟酸、堿、鹽都能發(fā)生反應(yīng)的物質(zhì)是
A.CaO B.Na2CO3 C.CaCO3 D.CO2
√
CaO是堿性氧化物,與堿不發(fā)生反應(yīng);CO2是酸性氧化物,與酸不發(fā)生反應(yīng);Na2CO3和CaCO3都是鹽,但CaCO3難溶于水,不與堿、鹽發(fā)生反應(yīng),Na2CO3可分別與鹽酸、氫氧化鈣、氯化鈣等發(fā)生反應(yīng)。
練習(xí)2
現(xiàn)有Na2SO4、NaOH、NaCl、Na2CO3四種物質(zhì)的溶液,分別與不同物質(zhì)反應(yīng),都有同一種化合物X生成,則化合物X的化學(xué)式可能為
A.NaHCO3 B.NaNO3
C.AgCl D.BaSO4
√
Na2SO4和Ba(NO3)2反應(yīng),NaOH和HNO3反應(yīng),NaCl和AgNO3反應(yīng),Na2CO3和HNO3反應(yīng),都生成同一種化合物NaNO3。
1.物質(zhì)轉(zhuǎn)化的實(shí)例
元素守恒是考慮如何實(shí)現(xiàn)物質(zhì)之間轉(zhuǎn)化的最基本的依據(jù)。
(1)以鈣為例,用化學(xué)方程式表示鈣及其化合物之間的轉(zhuǎn)化關(guān)系(如圖),并指明反應(yīng)類型。
①2Ca+O2===2CaO,化合反應(yīng);
②CaO+H2O===Ca(OH)2,化合反應(yīng);
③CaO+CO2===CaCO3,化合反應(yīng);
④Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,復(fù)分解反應(yīng);
⑤Ca(OH)2+2HCl===CaCl2+2H2O,復(fù)分解反應(yīng);
⑥CaCO3+2HCl===CaCl2+CO2↑+H2O,復(fù)分解反應(yīng)。
目標(biāo)二 物質(zhì)的轉(zhuǎn)化
1.物質(zhì)轉(zhuǎn)化的實(shí)例
(2)碳及其化合物間的轉(zhuǎn)化關(guān)系如下圖所示。
寫出圖中序號(hào)所示轉(zhuǎn)化所需反應(yīng)物的化學(xué)式:
①O2;②H2O;③Ca(OH)2;④CaO;⑤Ca(OH)2(答案合理即可)。
思考1
金屬單質(zhì)
堿性氧化物
堿
鹽
O2
H2O
基于上述轉(zhuǎn)化關(guān)系,從物質(zhì)分類的角度,尋找從單質(zhì)到鹽的轉(zhuǎn)化規(guī)律。
O2
H2O
酸性氧化物
酸
轉(zhuǎn)化規(guī)律
Ca
Ca(OH)2
CaSO4
CaO
SO3 H2SO4
非金屬單質(zhì)
酸性氧化物
酸
鹽
O2
H2O
堿性氧化物
堿
C
H2CO3
CO2
CaCO3
Ca(OH)2 CaO
O2
H2O
2.物質(zhì)轉(zhuǎn)化的應(yīng)用——物質(zhì)制備方法的選擇
(1)確定物質(zhì)制備方法的依據(jù)
①物質(zhì)的組成和性質(zhì);②物質(zhì)之間的轉(zhuǎn)化關(guān)系。
(2)工業(yè)生產(chǎn)中最適當(dāng)方法的選擇
目標(biāo)二 物質(zhì)的轉(zhuǎn)化
思考2
以工業(yè)上制取NaOH為例,思考討論并回答下列問題:
(1)選用兩種方法制取氫氧化鈉,并寫出相關(guān)反應(yīng)的化學(xué)方程式。
提示 ①堿性氧化物與水反應(yīng),Na2O+H2O ===2NaOH ;
②鹽與另一種堿反應(yīng),Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。
(2)從原料來源、成本等角度考慮工業(yè)上能否用上述兩種方法制取氫氧化鈉?現(xiàn)在主要采用什么方法制取氫氧化鈉?
提示 方法①不能用來制取氫氧化鈉,因?yàn)镹a2O作為原料,來源少、成本高;過去曾采用方法②。現(xiàn)在工業(yè)上主要采用電解飽和食鹽水的方法制取氫氧化鈉。
練習(xí)1
(教材習(xí)題第7題改編)以鐵、氧化銅、硫酸三種物質(zhì)為原料,用兩種方法制取銅。
(1)寫出反應(yīng)的化學(xué)方程式。
方法②:CuO+H2SO4===CuSO4+H2O,F(xiàn)e+CuSO4===Cu+FeSO4。
(2)對比兩種方法的優(yōu)缺點(diǎn),你認(rèn)為哪一種方法更好?并指明原因。
提示 方法②好。方法①加熱易爆炸,消耗能源多,且氫氣很難與氧化銅充分反應(yīng),利用率低,產(chǎn)品不純。
練習(xí)2
氯化鎂是一種鹽,請按要求寫出一個(gè)生成氯化鎂的化學(xué)方程式。
(1)置換反應(yīng):_________________________;
(2)堿與酸反應(yīng):_______________________________;
(3)鹽與酸反應(yīng):____________________________________;
(4)鹽與鹽反應(yīng):________________________________;
(5)堿性氧化物與酸反應(yīng):___________________________。
Mg+2HCl===MgCl2+H2↑
Mg(OH)2+2HCl===MgCl2+2H2O
MgCO3+2HCl===MgCl2+CO2↑+H2O
MgSO4+BaCl2===MgCl2+BaSO4↓
MgO+2HCl===MgCl2+H2O
學(xué)習(xí)小結(jié)
單質(zhì)、氧化物、酸、堿、鹽之間的轉(zhuǎn)化關(guān)系
1
2
3
自我測試
1.(2022·廣東普寧高一開學(xué)考試)化學(xué)與生活、社會(huì)發(fā)展息息相關(guān),下列說法錯(cuò)誤的是
A.“熬膽礬鐵釜,久之亦化為銅”,該過程發(fā)生了置換反應(yīng)
B.“霾塵積聚難見路人”,霧霾所形成的氣溶膠能產(chǎn)生丁達(dá)爾效應(yīng)
C.“千錘萬鑿出深山,烈火焚燒若等閑”,石灰石煅燒成石灰發(fā)生分解反應(yīng)
D.“青蒿一握,以水二升漬,絞取汁”,該過程中一定發(fā)生了化學(xué)變化
√
Fe + CuSO4 === Cu + FeSO4
用水浸取藥物,物理變化
CaCO3 === CaO + CO2 ↑
高溫
1
2
3
自我測試
2.(2021·昆明八中高一月考)下列物質(zhì)間的轉(zhuǎn)化不能一步實(shí)現(xiàn)的是
A.CaO―→Ca(OH)2―→CaSO4
B.Fe2O3―→FeCl3―→Fe(OH)3
C.C―→CO―→CaCO3
D.Cu―→CuO―→CuSO4
√
C和CO2反應(yīng)生成CO
CO―→CaCO3不能一步實(shí)現(xiàn)
1
2
3
自我測試
3.硫酸、碳酸鈉、二氧化碳、銅片、氫氧化鋇、氫氧化鈉、鐵片、生石灰和木炭粉9種物質(zhì)中的幾種存在如圖所示關(guān)系,選擇適當(dāng)?shù)奈镔|(zhì),使連線的兩種物質(zhì)能發(fā)生反應(yīng)(酸、堿、鹽均配制成稀溶液)。
(1)寫出下列序號(hào)對應(yīng)物質(zhì)的化學(xué)式:
①___;②______;③____;④________;⑤_______。
(2)寫出下列序號(hào)對應(yīng)物質(zhì)之間發(fā)生反應(yīng)的化學(xué)方程式:
①和②:__________________________;
②和④:__________________________________;
②和⑤:______________________________________;
④和⑤:_____________________________________。
Fe
H2SO4
CO2
Ba(OH)2
Na2CO3
Fe+H2SO4===FeSO4+H2↑
H2SO4+Ba(OH)2===BaSO4↓+2H2O
H2SO4+Na2CO3===Na2SO4+H2O+CO2↑
Ba(OH)2+Na2CO3===BaCO3↓+2NaOH
1
2
3
自我測試
Cu、Fe、C三種單質(zhì)中,只有Fe能與稀硫酸反
應(yīng),生成FeSO4和H2,故①為Fe,②為硫酸,
堿可能是NaOH或Ba(OH)2,鹽只有Na2CO3,
而NaOH不能與Na2CO3反應(yīng),故④為Ba(OH)2,
⑤為Na2CO3,
③為氧化物,且能與堿反應(yīng),則應(yīng)該為酸性氧化物,即CO2。
酸性氧化物的 主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
與水反應(yīng)
與堿反應(yīng)
與堿性氧化物反應(yīng)
與單質(zhì)反應(yīng)
1.酸性氧化物的化學(xué)性質(zhì)
酸性氧化物+水→酸
酸性氧化物+堿→鹽+水
酸性氧化物+堿性氧化物→鹽
CO2+Ca(OH)2===CaCO3↓+H2O
CO2+CaO===CaCO3
CO2+C 2CO
===
高溫
拓 展 培 優(yōu)
SO3+H2O===H2SO4
酸性氧化物的 主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
與水反應(yīng)
與酸反應(yīng)
與酸性氧化物反應(yīng)
與單質(zhì)反應(yīng)
2.堿性氧化物的化學(xué)性質(zhì)
Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O
堿性氧化物+水→堿
堿性氧化物+酸→鹽+水
CuO+C Cu+CO
===
高溫
堿性氧化物+酸性氧化物→鹽
拓 展 培 優(yōu)
Na2O + H2O ===2NaOH
CaO + SO2 === CaSO3
金屬的主要化學(xué)性質(zhì) 反應(yīng)實(shí)例(寫出化學(xué)方程式 ) 反應(yīng)通式
與非金屬反應(yīng)
與酸反應(yīng)
與鹽反應(yīng)
3.金屬的化學(xué)性質(zhì)
3Fe+2O2===Fe3O4
2Fe+3Cl2===2FeCl3
金屬+氧氣→堿性氧化物
金屬+非金屬→鹽
Fe + H2SO4 ===FeSO4 + H2↑
活潑金屬+酸→鹽+氫氣
Fe+CuSO4===FeSO4+Cu
金屬單質(zhì)+鹽→
新鹽+新金屬單質(zhì)
拓 展 培 優(yōu)
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽