資源簡介
資源簡介
(共13張PPT)
第二節 化學反應的速率與限度
第2課時 化學反應的限度
第六章 化學反應與能量變化
人教版化學 必修2
你還記得嗎?
氯水中存在哪些微粒?
氯氣能與水反應,為何氯水中還存在“氯氣分子”呢?
分子:Cl2、H2O、HClO
離子:H+、Cl-、OH-、ClO-
Cl2+H2O HCl+HClO
NH3 + H2O
NH3·H2O
NH4+ + OH-
氨水中存在哪些微粒?
分子:NH3·H2O、NH3、H2O
離子:NH4+、H+、OH-
氨氣能與水反應,為何氯水中還存在“氨氣分子”呢?
化學反應是有限度的,有些能進行地較徹底,有些反應是不徹底的,甚至是可逆的。
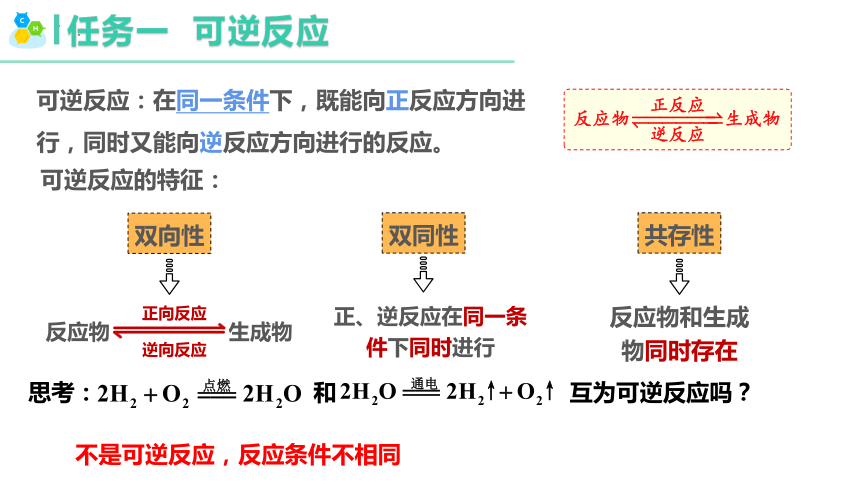
任務一 可逆反應
可逆反應:在同一條件下,既能向正反應方向進行,同時又能向逆反應方向進行的反應。
雙向性
雙同性
共存性
反應物 生成物
正向反應
逆向反應
正、逆反應在同一條件下同時進行
反應物和生成物同時存在
可逆反應的特征:
思考: 和 互為可逆反應嗎?
不是可逆反應,反應條件不相同
不是可逆反應,反應條件不相同
任務一 可逆反應
對于可逆反應2SO2+O2 2SO3,在混合氣體中充入一定量的18O2,足夠長時間后,18O原子
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中
D
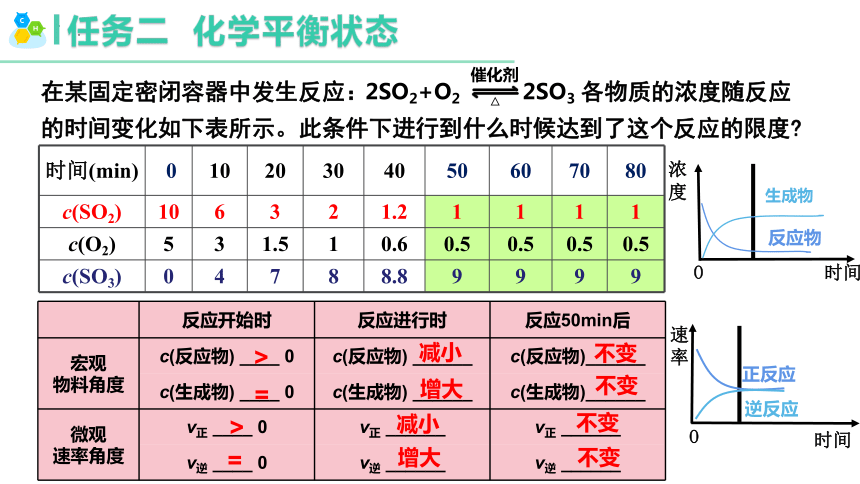
任務二 化學平衡狀態
在某固定密閉容器中發生反應: 各物質的濃度隨反應的時間變化如下表所示。此條件下進行到什么時候達到了這個反應的限度
時間(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
2SO2+O2 2SO3
催化劑
△
反應開始時 反應進行時 反應50min后
宏觀 物料角度 c(反應物) ____ 0 c(反應物) ______ c(反應物)______
c(生成物) ____ 0 c(生成物) ______ c(生成物)______
微觀 速率角度 v正 ____ 0 v正 ______ v正 ______
v逆 ____ 0 v逆 ______ v逆 ______
>
=
>
=
減小
增大
減小
增大
不變
不變
不變
不變
O
時間
濃度
生成物
反應物
時間
速率
O
正反應
逆反應
任務二 化學平衡狀態
可逆反應中:當正反應速率和逆反應速率相等,反應中各組分的濃度保持不變,達到一種表面靜止的狀態,則為“化學平衡狀態”。
前提
實質
標志
可逆反應
ν (正) = ν (逆)
逆
等
動
≠0
動態平衡
定
各組分的濃度保持不變
變
條件改變,原平衡被破壞,平衡移動,
在新的條件下建立新的平衡
判斷可逆反應是否達到平衡。
v(正)>v(逆)
v(正)
v(逆)
反應速率
時間(t)
反應處于平衡狀態
t1
v(正)= v(逆)
課堂練習
合成氨工業對國民經濟和社會發展具有重要的意義。對于密閉容器中的反應:
N2(g)+3H2(g) 2NH3(g),
673 K、30 MPa下,n(NH3)和n(H2)隨時間t 變化的關系如圖所示。下列敘述中正確的是
A.c點處正反應速率和逆反應速率相等
B.a點的正反應速率比b點的大
C.d點(t1時刻)和e點(t2時刻)處n(N2)不同
D.在t2時刻,正反應速率大于逆反應速率
B
高溫、高壓
催化劑
任務二 化學平衡狀態的判斷
如何理解 v正 = v逆≠0?
核心:1.有正有逆的描述;2.轉化為同一物質速率相等
一定條件下,對于可逆反應N2+3H2 2NH3,表示正、逆反應速率可以用N2或H2或NH3來表示:下列能表示反應達到化學平衡狀態的是
(1)單位時間內,有1mol N2消耗,同時有1mol N2生成
(2)單位時間內,有3mol H2消耗,同時有2mol NH3生成
(3)單位時間內,有1mol N2消耗,同時有3mol H2消耗
(4)1mol N≡N 鍵斷裂的同時有2mol N-H 鍵斷裂
(5)2v正(N2)=v逆(NH3)
(6)v(H2): v(N2) =3:1
(1) (5)
解題方法:一看有無正逆,二看是否等于系數之比
直接標志——“正逆相等”
任務二 化學平衡狀態的判斷
如何理解 “定”?
核心:一個量隨反應一直變,突然不變
間接標志——“變量不變”
一定條件下,對于可逆反應N2+3H2 2NH3,表示正、逆反應速率可以用N2或H2或NH3來表示,下列能表示反應達到化學平衡狀態的是
(1)容器內氮氣的物質的量不再改變
(2)c(N2):c(H2):c(NH3)=1:3:2
(3)容器內顏色不再改變
(4)固定容器恒容條件下,容器內氣體壓強不再改變
(5)固定容器恒容條件下,容器內氣體密度不再改變
(6)恒容或恒壓條件,容器內氣體平均相對分子質量不再改變
(1) (4) (6)
解題方法:判斷這個物理量是否為變量
任務二 化學平衡狀態的判斷
如何理解 “定”?
核心:一個量隨反應一直變,突然不變
a.各物質的質量、物質的量、分子數目保持不變。
b.各物質的物質的量濃度、質量分數保持不變。
c.反應物的轉化率、生成物的產率保持不變。
d.體系的顏色和溫度不變
①一定是變量的物理量——單一物質
不是相等,
也不是成比例
各組分的濃度保持不變
總壓強、氣體密度、氣體的總物質的量、氣體平均分子質量、氣體的體積分數需要具體情況具體分析
②不一定是變量的物理量——混合氣體
間接標志——“變量不變”
課堂練習
在一定溫度下的恒容容器中,當發生下列物理量不在發生變化時,能說明反應達到平衡狀態的是?完成表格:
混合 氣體 的 壓強 混合 氣體 的 密度 混合 氣體 的 總物質的量 混合 氣體的平均相對分子質量 混合 氣體 的 顏色 各反應物生成物的濃度之比等于化學計量數之比 某種氣體的百分含量
2SO2(g)+O2(g) 2SO3(g)
2NO2(g) N2O4(g)
C(s)+CO2(g) 2CO(g)
I2(g)+H2(g) 2HI(g)
5CO(g)+I2O5(s) 5CO2(g)+I2(s)
NH2COONH4(s) 2NH3(g)+CO2(g)
×
×
×
×
×
×
×
×
×
×
×
×
×
×
×
×
×
×
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
×
×
×
√
√
√
√
任務三 化學反應條件的控制
結合教材P48以工業合成氨氣為例,回答化工生產中反應條件如何調控?
思考:從速率和平衡的角度分析,工業上為什么通常采用400~500℃,10~30 Mpa條件合成氨氣?
化工生產中調控反應條件時,需要考慮控制反應條件的成本和實際可能性。
工業合成氨
溫度低,反應速率小,氨的產率高
壓強大,反應速率大,氨的產率高,對動力與生產設備要求高
使用催化劑能很大程度加快反應速率
綜合考慮
采用條件
溫度400~500℃
壓強10~30 Mpa
使用催化劑
任務三 化學反應條件的控制
為實現“碳達峰”“碳中和”的目標,提高燃料的燃燒效率與熱量的利用率也是重要措施之一。站在科學的人本情懷角度,結合所學試回答下列問題。
思考:煤燃燒時,將煤塊粉碎成煤粉且通入適當過量空氣的目的是什么?
煤塊粉碎成煤粉
增大其與空氣中O2的接觸面積
提高反應速率
煤粉燃燒更充分
通入適當過量的空氣
煤粉充分燃燒
生成CO2放出能量
空氣不足,會造成煤燃燒不完全,生成CO,產生熱量少,且造成污染
展開更多......
收起↑
 資源預覽
資源預覽