資源簡介
資源簡介
中小學(xué)教育資源及組卷應(yīng)用平臺
上海市2024-2025學(xué)年高一下學(xué)期化學(xué)期末模擬預(yù)測卷
一.解答題(共8小題)
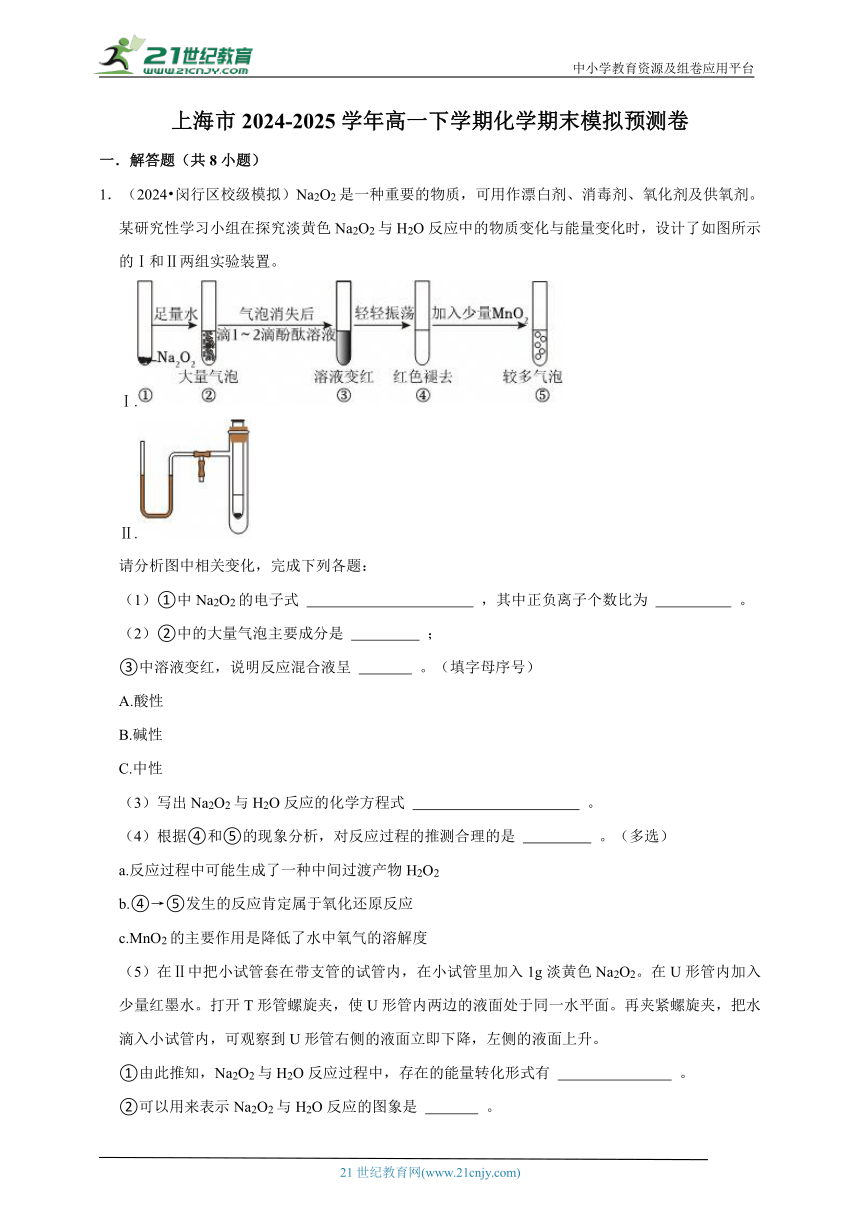
1.(2024 閔行區(qū)校級模擬)Na2O2是一種重要的物質(zhì),可用作漂白劑、消毒劑、氧化劑及供氧劑。某研究性學(xué)習(xí)小組在探究淡黃色Na2O2與H2O反應(yīng)中的物質(zhì)變化與能量變化時,設(shè)計了如圖所示的Ⅰ和Ⅱ兩組實驗裝置。
Ⅰ.
Ⅱ.
請分析圖中相關(guān)變化,完成下列各題:
(1)①中Na2O2的電子式 ,其中正負(fù)離子個數(shù)比為 。
(2)②中的大量氣泡主要成分是 ;
③中溶液變紅,說明反應(yīng)混合液呈 。(填字母序號)
A.酸性
B.堿性
C.中性
(3)寫出Na2O2與H2O反應(yīng)的化學(xué)方程式 。
(4)根據(jù)④和⑤的現(xiàn)象分析,對反應(yīng)過程的推測合理的是 。(多選)
a.反應(yīng)過程中可能生成了一種中間過渡產(chǎn)物H2O2
b.④→⑤發(fā)生的反應(yīng)肯定屬于氧化還原反應(yīng)
c.MnO2的主要作用是降低了水中氧氣的溶解度
(5)在Ⅱ中把小試管套在帶支管的試管內(nèi),在小試管里加入1g淡黃色Na2O2。在U形管內(nèi)加入少量紅墨水。打開T形管螺旋夾,使U形管內(nèi)兩邊的液面處于同一水平面。再夾緊螺旋夾,把水滴入小試管內(nèi),可觀察到U形管右側(cè)的液面立即下降,左側(cè)的液面上升。
①由此推知,Na2O2與H2O反應(yīng)過程中,存在的能量轉(zhuǎn)化形式有 。
②可以用來表示Na2O2與H2O反應(yīng)的圖象是 。
(6)從化學(xué)反應(yīng)過程中舊鍵斷裂和新鍵形成角度,分析Ⅱ中“U形管右側(cè)的液面立即下降,左側(cè)的液面上升”的原因: 。
(7)分析Na2O2與H2O反應(yīng)時的物質(zhì)轉(zhuǎn)化關(guān)系,試推測16g CH4完全燃燒的產(chǎn)物通入足量的Na2O2固體粉末中,充分吸收,Na2O2增重應(yīng)為 。
2.(2023春 浦東新區(qū)校級期末)硼族元素是指元素周期表中ⅢA族硼(B)、鋁(Al)、鎵(Ga)等元素。工業(yè)上提取鋁一般分兩步進(jìn)行:先從鋁土礦中提取Al2O3,然后電解Al2O3得制Al。回答下列問題:
(1)書寫電解Al2O3制備鋁單質(zhì)的方程式: ;工業(yè)上不通過電解AlCl3而通過電解Al2O3制備鋁單質(zhì)的原因是: 。
(2)將Al(OH)3和Na2CO3,一同溶于氫氟酸,可得到電解法制鋁所需要的助熔劑冰晶石(Na3AlF6),配平該反應(yīng)的方程式: Al(OH)3+ HF+ Na2CO3═ Na3AlF6+ CO2↑+ H2O。
一些硼的鹵化物的沸點如下表所示:
鹵化物 BF3 BCl3 BBr3
沸點/℃ ﹣100.3 12.5 90
回答下列問題:
(3)表中三種鹵化物分子的空間構(gòu)型均為平面正三角形,由此推斷F﹣B﹣F的鍵角為 。
(4)解釋表中三種鹵化硼沸點存在差異的原因: 。
硼酸(H3BO3)是一種具有防腐作用的弱酸,其電離過程的微觀圖示如圖:
回答下列問題:
(5)向NaOH溶液中滴加少量硼酸,反應(yīng)的離子方程式為 。
(6)在氧化劑存在下,硼和強(qiáng)堿共熔發(fā)生如下反應(yīng)生成偏硼酸鹽: B+ NaOH+ KNO3= NaBO2+ KNO2+ H2O。配平上述反應(yīng)。
3.(2024秋 普陀區(qū)校級期末)Ⅰ、將一小塊金屬鈉放置于空氣中,會依次產(chǎn)生下述一系列變化:
①白色固體A是一種正鹽,寫出生成白色固體A的方程式: 。標(biāo)況下有3.36LCO2參與反應(yīng)時,消耗的NaOH的質(zhì)量為 g。
②上述變化過程中共出現(xiàn)了7種物質(zhì):Na、O2、Na2O、H2O、NaOH、CO2和白色固體A。有關(guān)這些物質(zhì)說法正確的是 。
A.屬于電解質(zhì)的一共有4種
B.屬于非電解質(zhì)的一共有3種
C.熔化克服分子間作用力的共有4種
D.熔融狀態(tài)下導(dǎo)電的共有3種
③欲證明Na2O是否是電解質(zhì),給出一種實驗方案: 。
④將白色固體A溶于水后,繼續(xù)通入CO2,可以得到一種酸式鹽B。寫出酸式鹽B的電離方程式: 。
Ⅱ、若在上述流程中將Na與O2的反應(yīng)條件改為點燃,則可得到不一樣的變化流程:
⑤寫出Na2O2的電子式:。
⑥關(guān)于Na2O與Na2O2,下列說法正確的是 。
A.都屬于堿性氧化物
B.都屬于電解質(zhì)
C.正負(fù)離子個數(shù)比都為2比1
D.所含化學(xué)鍵種類完全相同
Ⅲ、過氧化鈉與水的反應(yīng)方程式為:2Na2O2+2H2O=4NaOH+O2↑。利用同位素示蹤法探究Na2O2和水的反應(yīng),用18O標(biāo)記Na2O2,發(fā)現(xiàn)收集到的氧氣全部都是18O2。
⑦在8.中含中子的個數(shù)為 。
⑧下列有關(guān)說法正確的是 。
A.16O2和18O2互為同位素
B.16O2和18O2互為同素異形體
C.18O的結(jié)構(gòu)示意圖為
D.18O的電子式為:
⑨書寫與水反應(yīng)的方程式: 。
⑩如果將Na2O2投入到FeCl3溶液中,你預(yù)測反應(yīng)后的分散系可能具有的性質(zhì)是 。
A.分散質(zhì)的粒子直徑在1~100nm之間
B.能夠產(chǎn)生丁達(dá)爾現(xiàn)象
C.分散質(zhì)粒子難以透過濾紙和半透膜
D.靜置片刻后,分散系能夠保持均一、透明、穩(wěn)定
通過以上實驗與信息,你能夠得到哪些結(jié)論? 。
A.金屬鈉與氧氣反應(yīng)的條件不同,產(chǎn)物也不同
B.過氧化鈉與氧化鈉在空氣中長期放置,最終產(chǎn)物不同
C.等物質(zhì)的量的氧化鈉與過氧化鈉置于等量的水中反應(yīng),不考慮水汽揮發(fā),形成不飽和溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)相等
D.僅憑肉眼觀察,無法區(qū)分氧化鈉與過氧化鈉
4.(2025 閔行區(qū)模擬)氯化鐵(FeCl3)在水處理、金屬蝕刻、印染、有機(jī)合成等領(lǐng)域有著廣泛的應(yīng)用。
(1)如圖1所示,F(xiàn)eCl3溶液與Cu、C可形成原電池。Cu發(fā)生 反應(yīng),電子經(jīng)導(dǎo)線從 流向 。總反應(yīng)的化學(xué)方程式為 。
(2)實驗室用FeCl3 6H2O配制100mL0.200mol L﹣1FeCl3溶液,需要使用的玻璃儀器,除燒杯、玻璃棒外,還有 、 。
(3)檢驗FeCl3溶液中Fe3+的試劑為 。(雙選)
A.氯水
B.KSCN溶液
C.NaOH溶液
D.FeCl2溶液
某同學(xué)向盛有FeCl3溶液的燒杯中加入CaCO3粉末,發(fā)現(xiàn)有無色氣泡產(chǎn)生。靜置24小時,可觀察到燒杯內(nèi)液體變?yōu)橥该鞯募t褐色,猜想得到了Fe(OH)3膠體。
(4)判斷Fe(OH)3膠體的最簡單方法為 。
(5)此反應(yīng)的化學(xué)方程式為 。
(6)分離該紅褐色液體與燒杯底部石灰石的方法是 。
A.過濾
B.蒸餾
C.萃取分液
已知FeCl3遇水極易水解,原理是:2FeCl3+3H2O 2Fe(OH)3+3HCl,為了探究外界條件對氯化鐵水解平衡的影響,某興趣小組設(shè)計實驗方案,獲得如下數(shù)據(jù)(FeCl3的濃度為1mol L﹣1,忽略溶液體積的變化)。已知:pH數(shù)值越小,酸性越強(qiáng)。
實驗 V(FeCl3)/mL V(H2O)/mL n(NaCl)/mol n(Na2SO4)/mol 溫度/℃ pH
1 10 0 0 0 25 0.74
2 10 90 0 0 25 1.62
3 10 90 0 0 35 1.47
4 10 90 a 0 25 x
5 10 90 0 b 25 y
(7)實驗2和實驗3的目的是 。
繼續(xù)查閱資料發(fā)現(xiàn),加入強(qiáng)電解質(zhì)后,由于溶液中離子總濃度增大,離子間的相互作用增強(qiáng),水解程度會改變。該興趣小組利用手持技術(shù)得到實驗4和實驗5的結(jié)果分別如圖2和圖3所示。
(8)根據(jù)實驗現(xiàn)象,提出假設(shè):
a.Cl﹣對Fe3+的水解有促進(jìn)作用;
b. 。
(9)設(shè)計實驗證明假設(shè)a是否成立(寫出實驗操作、試劑、現(xiàn)象和結(jié)論) 。
5.(2025 虹口區(qū)二模)工業(yè)煙氣通常含有二氧化硫與氮氧化物,在排放前需經(jīng)脫硫脫硝處理。
如圖是“雙堿法”脫硫工藝路徑(部分產(chǎn)物已略)。
(1)反應(yīng)①常在吸收塔(結(jié)構(gòu)如圖所示)中進(jìn)行,為提高吸收效率,可采取的操作有 。(不定項)
A.煙氣從a口通入塔內(nèi)
B.增加煙氣流速
C.在塔內(nèi)填充堆積大量瓷環(huán)
D.NaOH溶液呈霧狀噴出
(2)若反應(yīng)①所得吸收液中Na2SO3與NaHSO3濃度相等。向該溶液中加入足量Ca(OH)2,用一個化學(xué)方程式表示反應(yīng)②: 。
(3)反應(yīng)②完成后,將CaSO3濾出洗凈后用蒸餾水充分浸泡,沉降后測得上層液pH為8。已知25℃時,Ksp(CaSO3)=1.0×10﹣6。對上層液中相關(guān)離子濃度關(guān)系敘述正確的是 。(不定項)
A.[Ca2+]=[]=1.0×10﹣3mol L﹣1
B.
C.2[Ca2+]+[H+]=2[]+[]+[OH﹣]
D.[]+[H+]=[OH﹣]+2[H2SO3]
(4)僅用反應(yīng)①進(jìn)行脫硫的方法稱為“鈉堿法”。已知原料NaOH的價格為4.9元/kg,Ca(OH)2的價格為0.56元/kg,處理相同質(zhì)量的SO2,“雙堿法”所需的原料成本較“鈉堿法”更低,原因是 。
NaClO溶液可用于煙氣脫硝。常溫下,調(diào)節(jié)NaClO溶液至不同pH,將煙氣以固定速率通過該吸收液,煙氣中的NO可轉(zhuǎn)化為NO3。測得NO去除率與吸收液pH關(guān)系如圖所示。
(5)已知煙氣中NO初始濃度為2.0×10﹣3g L﹣1,1L吸收液每分鐘可對500mL煙氣進(jìn)行脫硝處理。用溶液中濃度表示pH=8時的脫硝速率為 mol L﹣1 min﹣1,(忽略吸收液體積變化)
A.2.5×10﹣5
B.5.0×10﹣5
C.1.5×10﹣3
D.3.0×10﹣3
(6)已知氧化性HClO>NaClO。當(dāng)吸收液pH>8時,NO去除率隨pH升高迅速下降的原因是 。
科學(xué)家正著力研究用NH3—SCR反應(yīng)(NH3選擇性催化還原氮氧化物)對含NO的煙氣進(jìn)行脫硝,最終產(chǎn)物為無污染的N2和H2O,某種活性炭催化NH3—SCR脫硝的機(jī)理如下所示:
脫硝歷程 最高活化能Ea/kJ mol﹣1
階段①:2NO+O2═2NO2 118.9
階段②:2NO2+NH3═HNO3+NH2NO 19.1
階段③:HNO3+NO=NO2+HONO 105.3
階段④:NH2NO=N2+H2O 83.7
階段⑤:2HONO=NO2+NO+H2O 69.2
注:脫硝的每階段都包括若干基元反應(yīng),表中顯示的是該階段的總反應(yīng)以及各基元反應(yīng)活化能中數(shù)值最大的一個。
(7)根據(jù)上述反應(yīng)歷程可知NH3—SCR反應(yīng)的化學(xué)方程式為 。
A.4NH3+6NO5N2+6H2O
B.4NH3+3O22N2+6H2O
C.4NH3+2NO+2O23N2+6H2O
D.4NH3+4NO+O24N2+6H2O
(8)當(dāng)反應(yīng)溫度低于150℃時,隨著反應(yīng)進(jìn)行,NO的轉(zhuǎn)化率逐步下降,主要是因為催化劑表面出現(xiàn)白色固體沉積,覆蓋活性點位,該固體可能是 。
(9)研究發(fā)現(xiàn),將煙氣中部分NO預(yù)先氧化為NO2后再進(jìn)行NH3—SCR反應(yīng),可明顯提升單位時間內(nèi)的脫硝率,結(jié)合上表數(shù)據(jù)解釋可能的原因 。
6.(2025 浦東新區(qū)開學(xué))(1)煙氣脫硝是指通過一系列化學(xué)反應(yīng)將煙氣中的NO、NO2等氮的氧化物轉(zhuǎn)化為無污染的含氮物質(zhì)的過程。氧—氨水法是一種高效的工業(yè)脫硝技術(shù),主要流程圖如圖所示:
已知:O3+NO=NO2+O2;O3+2NO2=N2O5+O2。
①已知NO2為角形分子。下列關(guān)于NO、NO2說法正確的是 。
A.均屬于酸性氧化物
B.均屬于離子化合物
C.均屬于極性分子
D.均屬于電解質(zhì)
②靜電除塵的原理是含塵氣體經(jīng)高壓靜電場使塵粒帶電荷后,塵粒向帶相反電荷的電極定向移動,從而達(dá)到除塵目的。靜電除塵類似于膠體的 。
③X溶液中含有一種銨鹽,它由氨水與N2O5反應(yīng)生成,寫出反應(yīng)的離子方程式 。
④O3/NO摩爾比對NO脫除率以及NO2轉(zhuǎn)化率的影響如圖所示。分析最佳O3/NO摩爾比為 。
(2)脫硝反應(yīng)之一:2NO2(g)+O3(g) N2O5(g)+O2(g)ΔH<0,T℃時,向1.0L恒容密閉容器中充入2.0mol NO2和1.0mol O3,反應(yīng)過程中測定的部分?jǐn)?shù)據(jù)見表:
t/s 0 3 6 12 24
n(O2)/mol 0 0.36 0.60 0.80 0.80
①反應(yīng)在0~3s內(nèi)的平均速率v(NO2)= 。
②下列描述中能說明上述反應(yīng)已達(dá)平衡的是 。
A.混合氣體密度不再變化
B.單位時間內(nèi)消耗2mol NO2的同時生成1mol O2
C.v正(NO2)=2v逆(N2O5)
D.混合氣體壓強(qiáng)不再變化
③T℃時,上述脫硝反應(yīng)的化學(xué)平衡常數(shù)等于 。
④T℃時,若向上述容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,開始時反應(yīng) 。
A.正向進(jìn)行
B.逆向進(jìn)行
C.達(dá)平衡
(3)如圖裝置能有效去除煙氣中的NO2,已知該電池反應(yīng)為:6NO2+8NH3=7N2+12H2O。
①A電極通過導(dǎo)線 電子。
A.流出
B.流入
②B電極的電極反應(yīng)式 。
(4)利用催化劑ZAg對NO催化轉(zhuǎn)化的反應(yīng)過程與能量變化如圖所示。
①下列說法正確的是 。
A.高溫下有利于NO的轉(zhuǎn)化
B.由a釋放N2O的反應(yīng)速率最慢
C.a(chǎn)到b、d到e,都會形成非極性鍵
D.過渡態(tài)2比過渡態(tài)1穩(wěn)定
②寫出總反應(yīng)的熱化學(xué)方程式 。
③判斷在上述實驗條件時該反應(yīng)是否會自發(fā)地進(jìn)行并說明判斷理由 。
(5)O2在一定條件下能有效去除煙氣中的NO,其可能的反應(yīng)機(jī)理如圖所示( OH表示羥基自由基,其中O元素為﹣1價, 表示未成對電子)。在 (填“陰”或“陽”)極生成,在凈化器中生成1mol HNO3,消耗 OH的數(shù)目為 。
7.(2024秋 黃浦區(qū)校級期末)石油和煤不僅是人類使用最多的能源,也是重要的化學(xué)原料和寶貴的資源,它們是化工原料的兩大主要來源。
(1)下列石油分餾產(chǎn)品中,沸點范圍最高的是 。
A.瀝青
B.柴油
C.潤滑油
D.汽油
(2)下列過程不涉及化學(xué)變化的是 。
A.煤的氣化和液化
B.石油的分餾
C.石油的裂化、裂解
D.煤干餾
石油是多種烴類的混合物,回答下列烴類相關(guān)問題
(3)下列褪色過程是因為發(fā)生加成反應(yīng)而褪色的是 。
A.甲烷和氯氣混合光照后黃綠色消失
B.乙烯通入酸性高錳酸鉀溶液后溶液褪色
C.乙烯加入溴的四氯化碳溶液后,溶液褪色
D.將苯加入溴水中振蕩后水層接近無色
(4)同溫同壓下,1體積某氣態(tài)烴只能與1體積HCl氣體發(fā)生加成反應(yīng),生成氯代烷。1mol此氯代烷可與5mol Cl2發(fā)生完全的取代反應(yīng),則該烴的結(jié)構(gòu)簡式為 。
A.CH3CH=CH2
B.CH2=CH2
C.CH3CH3
D.CH3CH2CH=CH2
(5)標(biāo)準(zhǔn)狀況下,4.48升氣態(tài)混合烴在足量氧氣中完全燃燒后得到6.72升二氧化碳和7.2克水,則下列對氣態(tài)混合烴的描述正確的是 。
A.一定含乙烷
B.一定含乙烯
C.一定含甲烷
D.可能含乙烯
8.(2024春 寶山區(qū)校級期末)自然界和人工合成的物質(zhì)中,絕大多數(shù)是有機(jī)化合物。有機(jī)化合物種類繁多,性質(zhì)各異,與我們的生活、生產(chǎn)密切相關(guān)。其中煤、石油、天然氣為人類生產(chǎn)生活提供能量。請根據(jù)要求回答問題!
(1)石油的分餾是 (填“物理”或“化學(xué)”)變化。
(2)下列石油分餾產(chǎn)品中,沸點范圍最低的是 。
A.瀝青
B.汽油
C.石油氣
D.柴油
(3)某石化廠獲得大量乙烯、丙烯、丁二烯采用的方法是 。
A.石油的分餾
B.煤的干餾
C.石油的裂解
D.煤的氣化
(4)下列有關(guān)有機(jī)化合物說法正確的是 。
A.凡有甜味的有機(jī)化合物均屬于糖類
B.尼龍是天然高分子材料
C.蛋白質(zhì)、油脂、糖類是三大基本營養(yǎng)物質(zhì)
(5)既可以用來鑒別乙烷與乙烯,又可以用來除去乙烷中的乙烯的方法是 。
A.通過足量的NaOH溶液
B.通過溴的CCl4溶液
C.在Ni催化、加熱條件下通入過量H2
D.通過足量的酸性KMnO4溶液
糖類、油脂、蛋白質(zhì)是生命活動的物質(zhì)和能量基礎(chǔ)。淀粉是重要的營養(yǎng)物質(zhì),在大米、小麥、馬鈴薯中大量存在.淀粉在一定條件下可以水解生成葡萄糖,人體中葡萄糖在酶的作用下緩慢氧化,釋放能量以保證生命活動正常運行。以淀粉為主要原料,合成高分子化合物B和一種具有果香味的有機(jī)物C,合成路線如圖。
(6)A分子內(nèi)含有的官能團(tuán)是 (填名稱)。
(7)反應(yīng)Ⅰ的反應(yīng)類型: ;反應(yīng)Ⅲ的反應(yīng)類型: ;
(8)檢驗有化合物乙酸生成所需試劑是
A.酸性高錳酸鉀溶液
B.希夫試劑
C.碳酸氫鈉溶液
(9)寫出下列反應(yīng)的化學(xué)方程式:Ⅱ ;Ⅲ 。
上海市2024-2025學(xué)年高一下學(xué)期化學(xué)期末模擬預(yù)測卷
參考答案與試題解析
一.解答題(共8小題)
1.(2024 閔行區(qū)校級模擬)Na2O2是一種重要的物質(zhì),可用作漂白劑、消毒劑、氧化劑及供氧劑。某研究性學(xué)習(xí)小組在探究淡黃色Na2O2與H2O反應(yīng)中的物質(zhì)變化與能量變化時,設(shè)計了如圖所示的Ⅰ和Ⅱ兩組實驗裝置。
Ⅰ.
Ⅱ.
請分析圖中相關(guān)變化,完成下列各題:
(1)①中Na2O2的電子式 ,其中正負(fù)離子個數(shù)比為 2:1 。
(2)②中的大量氣泡主要成分是 氧氣 ;
③中溶液變紅,說明反應(yīng)混合液呈 B 。(填字母序號)
A.酸性
B.堿性
C.中性
(3)寫出Na2O2與H2O反應(yīng)的化學(xué)方程式 2Na2O2+2H2O=4NaOH+O2↑, 。
(4)根據(jù)④和⑤的現(xiàn)象分析,對反應(yīng)過程的推測合理的是 ab 。(多選)
a.反應(yīng)過程中可能生成了一種中間過渡產(chǎn)物H2O2
b.④→⑤發(fā)生的反應(yīng)肯定屬于氧化還原反應(yīng)
c.MnO2的主要作用是降低了水中氧氣的溶解度
(5)在Ⅱ中把小試管套在帶支管的試管內(nèi),在小試管里加入1g淡黃色Na2O2。在U形管內(nèi)加入少量紅墨水。打開T形管螺旋夾,使U形管內(nèi)兩邊的液面處于同一水平面。再夾緊螺旋夾,把水滴入小試管內(nèi),可觀察到U形管右側(cè)的液面立即下降,左側(cè)的液面上升。
①由此推知,Na2O2與H2O反應(yīng)過程中,存在的能量轉(zhuǎn)化形式有 化學(xué)能轉(zhuǎn)化為熱能 。
②可以用來表示Na2O2與H2O反應(yīng)的圖象是 B 。
(6)從化學(xué)反應(yīng)過程中舊鍵斷裂和新鍵形成角度,分析Ⅱ中“U形管右側(cè)的液面立即下降,左側(cè)的液面上升”的原因: Na2O2與H2O反應(yīng)是舊鍵斷裂和新鍵形成的過程,舊鍵斷裂需要吸收熱量,新鍵形成需要放出熱量,該反應(yīng)過程中新鍵形成放出的熱量高于舊鍵斷裂吸收的熱量,因此反應(yīng)放熱,試管內(nèi)溫度升高,壓強(qiáng)增大,U形管右側(cè)的液面立即下降,左側(cè)的液面上升 。
(7)分析Na2O2與H2O反應(yīng)時的物質(zhì)轉(zhuǎn)化關(guān)系,試推測16g CH4完全燃燒的產(chǎn)物通入足量的Na2O2固體粉末中,充分吸收,Na2O2增重應(yīng)為 32 。
【答案】(1);2:1;
(2)氧氣;B;
(3)2Na2O2+2H2O=4NaOH+O2↑;
(4)ab;
(5)①化學(xué)能轉(zhuǎn)化為熱能;
②B;
(6)Na2O2與H2O反應(yīng)是舊鍵斷裂和新鍵形成的過程,舊鍵斷裂需要吸收熱量,新鍵形成需要放出熱量,該反應(yīng)過程中新鍵形成放出的熱量高于舊鍵斷裂吸收的熱量,因此反應(yīng)放熱,試管內(nèi)溫度升高,壓強(qiáng)增大,U形管右側(cè)的液面立即下降,左側(cè)的液面上升;
(7)32g。
【分析】由題干實驗信息可知,向Na2O2固體中加入一定量的水,觀察到產(chǎn)生大量的氣泡,說明Na2O2與H2O反應(yīng)放出O2,而后滴加1~2滴酚酞溶液,溶液變紅,說明溶液顯堿性,而后褪色,說明有漂白性物質(zhì)生成可能是H2O2,即Na2O2+2H2O=2NaOH+H2O2,加入MnO2后又產(chǎn)生大量的氣泡,進(jìn)一步說明可能生成有H2O2,把水滴入小試管內(nèi),可觀察到U形管右側(cè)的液面立即下降,左側(cè)的液面上升,說明大試管中氣體的壓強(qiáng)增大,即由于該試管中氣體溫度上升膨脹,也說明Na2O2與H2O反應(yīng)過程中放熱,據(jù)此分析解答。
【解答】解:(1)Na2O2的電子式為,故正負(fù)離子的個數(shù)比為2:1,
故答案為:;2:1;
(2)由于過氧化鈉與水反應(yīng)生成氫氧化鈉和氧氣,因而②中的大量氣泡主要成分是氧氣,②中溶液滴加酚酞后,③中溶液變紅,說明反應(yīng)混合液呈堿性;
故答案為:氧氣;B;
(3)過氧化鈉與水反應(yīng)生成氫氧化鈉和氧氣,因而其化學(xué)反應(yīng)的方程式為:2Na2O2+2H2O=4NaOH+O2↑,
故答案為:2Na2O2+2H2O=4NaOH+O2↑;
(4)根據(jù)④和⑤中的現(xiàn)象即溶液紅色褪去,加入MnO2后產(chǎn)生大量的氣泡,據(jù)此可分析,
a.H2O2具有強(qiáng)氧化性,可以漂白酸堿指示劑,且H2O2在MnO2催化下迅速分解,釋放大量的氣泡,則推測反應(yīng)過程中可能生成了一種中間過渡產(chǎn)物H2O2,故a正確;
b.由A項分析可知,H2O2在MnO2催化下迅速分解,釋放大量的氣泡即O2,O的化合價發(fā)生改變,即④→⑤發(fā)生的反應(yīng)肯定屬于氧化還原反應(yīng),故b正確;
c.MnO2的主要作用是催化劑,而不是降低了水中氧氣的溶解度,故c錯誤;
d.由a項分析可知,⑤紅色褪去是由于H2O2的強(qiáng)氧化作用,而不是溶液堿性減弱,反滴入NaOH溶液紅色不會再現(xiàn),故d錯誤;
故答案為:ab;
(5)①在Ⅱ中把小試管套在帶支管的試管內(nèi),在小試管里加入1g淡黃色Na2O2,在U形管內(nèi)加入少量紅墨水。打開T形管螺旋夾,使U形管內(nèi)兩邊的液面處于同一水平面。再夾緊螺旋夾,把水滴入小試管內(nèi),可觀察到U形管右側(cè)的液面立即下降,左側(cè)的液面上升,說明Na2O2與H2O反應(yīng)過程中放出熱量,使得U形管右側(cè)氣體體積變大,液面下降,左側(cè)液面上升,即反應(yīng)過程中化學(xué)能轉(zhuǎn)化為熱能,
故答案為:化學(xué)能轉(zhuǎn)化為熱能;
②由于Na2O2與H2O反應(yīng)過程中放出熱量,因此反應(yīng)物的能量高于生成物的能量,即B圖象符合題意他,
故答案為:B;
(6)Ⅱ中“U形管右側(cè)的液面立即下降,左側(cè)的液面上升”的原因是:Na2O2與H2O反應(yīng)是舊鍵斷裂和新鍵形成的過程,舊鍵斷裂需要吸收熱量,新鍵形成需要放出熱量,該反應(yīng)過程中新鍵形成放出的熱量高于舊鍵斷裂吸收的熱量,因此反應(yīng)放熱,試管內(nèi)溫度升高,壓強(qiáng)增大,U形管右側(cè)的液面立即下降,左側(cè)的液面上升,
故答案為:Na2O2與H2O反應(yīng)是舊鍵斷裂和新鍵形成的過程,舊鍵斷裂需要吸收熱量,新鍵形成需要放出熱量,該反應(yīng)過程中新鍵形成放出的熱量高于舊鍵斷裂吸收的熱量,因此反應(yīng)放熱,試管內(nèi)溫度升高,壓強(qiáng)增大,U形管右側(cè)的液面立即下降,左側(cè)的液面上升;
(7)分析Na2O2與H2O反應(yīng)時的物質(zhì)轉(zhuǎn)化關(guān)系,由反應(yīng)方程式:CH4+2O2CO2+2H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑可知,CH4燃燒消耗的氧氣質(zhì)量等于生成CO2、H2O與Na2O2反應(yīng)放出的O2,故16gCH4完全燃燒的產(chǎn)物通入足量的Na2O2中,Na2O2增重應(yīng)為32g,
故答案為:32g。
【點評】本題主要考查氯及其化合物的相互轉(zhuǎn)化,同時考查學(xué)生對價類二維圖的理解與應(yīng)用,屬于基本知識的考查,難度中等。
2.(2023春 浦東新區(qū)校級期末)硼族元素是指元素周期表中ⅢA族硼(B)、鋁(Al)、鎵(Ga)等元素。工業(yè)上提取鋁一般分兩步進(jìn)行:先從鋁土礦中提取Al2O3,然后電解Al2O3得制Al。回答下列問題:
(1)書寫電解Al2O3制備鋁單質(zhì)的方程式: 2Al2O34Al+3O2↑ ;工業(yè)上不通過電解AlCl3而通過電解Al2O3制備鋁單質(zhì)的原因是: AlCl3是共價化合物,熔融狀態(tài)不導(dǎo)電 。
(2)將Al(OH)3和Na2CO3,一同溶于氫氟酸,可得到電解法制鋁所需要的助熔劑冰晶石(Na3AlF6),配平該反應(yīng)的方程式: 2 Al(OH)3+ 12 HF+ 3 Na2CO3═ 2 Na3AlF6+ 3 CO2↑+ 9 H2O。
一些硼的鹵化物的沸點如下表所示:
鹵化物 BF3 BCl3 BBr3
沸點/℃ ﹣100.3 12.5 90
回答下列問題:
(3)表中三種鹵化物分子的空間構(gòu)型均為平面正三角形,由此推斷F﹣B﹣F的鍵角為 120° 。
(4)解釋表中三種鹵化硼沸點存在差異的原因: BF3、BCl3、BBr3均為分子晶體,組成結(jié)構(gòu)相似,分子量依次增大,分子間作用力依次增大 。
硼酸(H3BO3)是一種具有防腐作用的弱酸,其電離過程的微觀圖示如圖:
回答下列問題:
(5)向NaOH溶液中滴加少量硼酸,反應(yīng)的離子方程式為 H3BO3+OH﹣=[B(OH)4]﹣ 。
(6)在氧化劑存在下,硼和強(qiáng)堿共熔發(fā)生如下反應(yīng)生成偏硼酸鹽: 2 B+ 2 NaOH+ 3 KNO3= 2 NaBO2+ 3 KNO2+ 1 H2O。配平上述反應(yīng)。
【答案】(1)2Al2O34Al+3O2↑;AlCl3是共價化合物,熔融狀態(tài)不導(dǎo)電;
(2)2;12;3;2;3;9;
(3)120°;
(4)BF3、BCl3、BBr3均為分子晶體,組成結(jié)構(gòu)相似,分子量依次增大,分子間作用力依次增大;
(5)H3BO3+OH﹣=[B(OH)4]﹣;
(6)2;2;3;2;3;1。
【分析】(1)工業(yè)上采用電解熔融氧化鋁的方法冶煉鋁,化學(xué)方程式為2Al2O34Al+3O2↑;AlCl3是共價化合物,熔融狀態(tài)不導(dǎo)電;
(2)HF與Al(OH)3、Na2CO3反應(yīng)生成冰晶石(Na3AlF6),同時生成二氧化碳、水;
(3)BF3的空間構(gòu)型為平面正三角形,B位于正三角形中心,F(xiàn)位于正三角形頂點;
(4)BF3、BCl3、BBr3均為分子晶體,組成結(jié)構(gòu)相似,分子量依次增大,分子間作用力依次增大;
(5)由圖中電離過程可知,硼酸為一元弱酸,硼酸與氫氧化鈉按1:1反應(yīng)生成Na[B(OH)4];
(6)B從0價升高到+3價,失去3個電子,KNO3中氮元素從+5價降低到+3價,得到2個電子。
【解答】解:(1)工業(yè)上采用電解熔融氧化鋁的方法冶煉鋁,化學(xué)方程式為2Al2O34Al+3O2↑;AlCl3是共價化合物,熔融狀態(tài)不導(dǎo)電,所以不通過電解AlCl3而通過電解Al2O3制備鋁單質(zhì),
故答案為:2Al2O34Al+3O2↑;AlCl3是共價化合物,熔融狀態(tài)不導(dǎo)電;
(2)HF與Al(OH)3、Na2CO3反應(yīng)生成冰晶石(Na3AlF6),同時生成二氧化碳、水,根據(jù)原子守恒配平反應(yīng)的方程式為:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O,
故答案為:2;12;3;2;3;9;
(3)BF3的空間構(gòu)型為平面正三角形,B位于正三角形中心,F(xiàn)位于正三角形頂點,可知F﹣B﹣F的鍵角為120°,
故答案為:120°;
(4)BF3、BCl3、BBr3均為分子晶體,組成結(jié)構(gòu)相似,分子量依次增大,分子間作用力依次增大,因此沸點依次升高,
故答案為:BF3、BCl3、BBr3均為分子晶體,組成結(jié)構(gòu)相似,分子量依次增大,分子間作用力依次增大;
(5)由圖中電離過程可知,硼酸為一元弱酸,硼酸與氫氧化鈉按1:1反應(yīng)生成Na[B(OH)4],反應(yīng)的離子方程式為H3BO3+OH﹣=[B(OH)4]﹣,
故答案為:H3BO3+OH﹣=[B(OH)4]﹣;
(6)B從0價升高到+3價,失去3個電子,KNO3中氮元素從+5價降低到+3價,得到2個電子,根據(jù)得失電子守恒和原子守恒配平方程式為2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O,
故答案為:2;2;3;2;3;1。
【點評】本題考查物質(zhì)的性質(zhì)和變化,側(cè)重考查學(xué)生基礎(chǔ)知識的掌握情況,試題難度中等。
3.(2024秋 普陀區(qū)校級期末)Ⅰ、將一小塊金屬鈉放置于空氣中,會依次產(chǎn)生下述一系列變化:
①白色固體A是一種正鹽,寫出生成白色固體A的方程式: CO2+2NaOH=Na2CO3+H2O 。標(biāo)況下有3.36LCO2參與反應(yīng)時,消耗的NaOH的質(zhì)量為 12 g。
②上述變化過程中共出現(xiàn)了7種物質(zhì):Na、O2、Na2O、H2O、NaOH、CO2和白色固體A。有關(guān)這些物質(zhì)說法正確的是 A 。
A.屬于電解質(zhì)的一共有4種
B.屬于非電解質(zhì)的一共有3種
C.熔化克服分子間作用力的共有4種
D.熔融狀態(tài)下導(dǎo)電的共有3種
③欲證明Na2O是否是電解質(zhì),給出一種實驗方案: 將Na2O熔融做導(dǎo)電實驗,若導(dǎo)電,則為電解質(zhì) 。
④將白色固體A溶于水后,繼續(xù)通入CO2,可以得到一種酸式鹽B。寫出酸式鹽B的電離方程式: 、 。
Ⅱ、若在上述流程中將Na與O2的反應(yīng)條件改為點燃,則可得到不一樣的變化流程:
⑤寫出Na2O2的電子式:。
⑥關(guān)于Na2O與Na2O2,下列說法正確的是 BC 。
A.都屬于堿性氧化物
B.都屬于電解質(zhì)
C.正負(fù)離子個數(shù)比都為2比1
D.所含化學(xué)鍵種類完全相同
Ⅲ、過氧化鈉與水的反應(yīng)方程式為:2Na2O2+2H2O=4NaOH+O2↑。利用同位素示蹤法探究Na2O2和水的反應(yīng),用18O標(biāo)記Na2O2,發(fā)現(xiàn)收集到的氧氣全部都是18O2。
⑦在8.中含中子的個數(shù)為 4.4NA 。
⑧下列有關(guān)說法正確的是 D 。
A.16O2和18O2互為同位素
B.16O2和18O2互為同素異形體
C.18O的結(jié)構(gòu)示意圖為
D.18O的電子式為:
⑨書寫與水反應(yīng)的方程式: 。
⑩如果將Na2O2投入到FeCl3溶液中,你預(yù)測反應(yīng)后的分散系可能具有的性質(zhì)是 C 。
A.分散質(zhì)的粒子直徑在1~100nm之間
B.能夠產(chǎn)生丁達(dá)爾現(xiàn)象
C.分散質(zhì)粒子難以透過濾紙和半透膜
D.靜置片刻后,分散系能夠保持均一、透明、穩(wěn)定
通過以上實驗與信息,你能夠得到哪些結(jié)論? AC 。
A.金屬鈉與氧氣反應(yīng)的條件不同,產(chǎn)物也不同
B.過氧化鈉與氧化鈉在空氣中長期放置,最終產(chǎn)物不同
C.等物質(zhì)的量的氧化鈉與過氧化鈉置于等量的水中反應(yīng),不考慮水汽揮發(fā),形成不飽和溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)相等
D.僅憑肉眼觀察,無法區(qū)分氧化鈉與過氧化鈉
【答案】①CO2+2NaOH=Na2CO3+H2O;12;
②A
③將Na2O熔融做導(dǎo)電實驗,若導(dǎo)電,則為電解質(zhì);
④、;
⑤;
⑥BC;
⑦4.4NA;
⑧D;
⑨;
⑩C;
AC。
【分析】①根據(jù)氫氧化鈉吸收二氧化碳所得的白色固體A是一種正鹽,則A為碳酸鈉進(jìn)行分析;
②根據(jù)電解質(zhì)是溶于水或熔融狀態(tài)下能導(dǎo)電的化合物,溶于水和熔融狀況下均不能導(dǎo)電的化合物是非電解質(zhì),分子構(gòu)成的物質(zhì)熔化時克服分子間的作用力,金屬單質(zhì)和離子化合物在熔融狀態(tài)下能導(dǎo)電,熔融狀態(tài)下能導(dǎo)電的物質(zhì)有鈉、氧化鈉、氫氧化鈉和碳酸鈉,進(jìn)行分析;
③根據(jù)電解質(zhì)是溶于水或熔融狀態(tài)下能導(dǎo)電的化合物,進(jìn)行分析;
④根據(jù)碳酸鈉、水和二氧化碳反應(yīng)生成碳酸氫鈉,進(jìn)行分析;
⑤根據(jù)Na2O2由鈉離子和過氧根離子構(gòu)成,進(jìn)行分析;
⑥根據(jù)氧化鈉和酸反應(yīng)生成鹽和水、屬于堿性氧化物,氧化鈉由鈉離子和氧離子構(gòu)成,過氧化鈉由鈉離子和過氧根離子構(gòu)成,進(jìn)行分析;
⑦根據(jù)質(zhì)量數(shù)=質(zhì)子數(shù)+中子數(shù),質(zhì)量數(shù)標(biāo)注于元素符號左上角、質(zhì)子數(shù)標(biāo)注于元素符號左下角進(jìn)行分析;
⑧根據(jù)同位素,同素異形體的定義進(jìn)行分析;
⑨根據(jù)與水反應(yīng),過氧化鈉中的氧化合價既升高又降低,水中的氧化合價不變,進(jìn)行分析;
⑩根據(jù)將Na2O2投入到FeCl3溶液中,鈉與水先反應(yīng)生成氫氧化鈉和氫氣,后氫氧化鈉與氯化鐵反應(yīng)生成氫氧化鐵沉淀進(jìn)行分析;
根據(jù)金屬鈉與氧氣反應(yīng)的條件不同,產(chǎn)物也不同,Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,過氧化鈉與氧化鈉在空氣中長期放置,均與水反應(yīng)、均轉(zhuǎn)變?yōu)闅溲趸c,均進(jìn)一步轉(zhuǎn)變成為最終產(chǎn)物碳酸鈉,進(jìn)行分析。
【解答】解:①據(jù)分析,生成白色固體A的化學(xué)方程式為:CO2+2NaOH=Na2CO3+H2O。標(biāo)況下有3.36L CO2參與反應(yīng)時,二氧化碳的物質(zhì)的量為,則消耗的NaOH0.3mol,質(zhì)量為0.3mol×40g/mol=12g,
故答案為:CO2+2NaOH=Na2CO3+H2O;12;
②A.電解質(zhì)是溶于水或熔融狀態(tài)下能導(dǎo)電的化合物,氧化鈉、水、氫氧化鈉和碳酸鈉屬于電解質(zhì),屬于電解質(zhì)的一共有4種,故A正確;
B.溶于水和熔融狀況下均不能導(dǎo)電的化合物是非電解質(zhì),二氧化碳的水溶液能導(dǎo)電,跟它自身的電離無關(guān),二氧化碳屬于非電解質(zhì),則屬于非電解質(zhì)的只有1種,故B錯誤;
C.由分子構(gòu)成的物質(zhì)熔化時克服分子間的作用力,因此熔化時克服分子間作用力的物質(zhì)有水,二氧化碳,氧氣,共有3種,故C錯誤;
D.金屬單質(zhì)和離子化合物在熔融狀態(tài)下能導(dǎo)電,熔融狀態(tài)下能導(dǎo)電的物質(zhì)有鈉、氧化鈉、氫氧化鈉和碳酸鈉,共有4種,故D錯誤;
故答案為:A。
③電解質(zhì)是溶于水或熔融狀態(tài)下能導(dǎo)電的化合物,欲證明Na2O是否是電解質(zhì),給出的一種實驗方案是:將Na2O熔融做導(dǎo)電實驗,若導(dǎo)電(燈泡亮/電流表偏轉(zhuǎn)/其他合理)則為電解質(zhì),
故答案為:將Na2O熔融做導(dǎo)電實驗,若導(dǎo)電,則為電解質(zhì);
④將白色固體A溶于水后,繼續(xù)通入CO2,可以得到一種酸式鹽B,即碳酸鈉、水和二氧化碳反應(yīng)生成碳酸氫鈉,B為碳酸氫鈉,在水中完全電離為鈉離子、碳酸氫根,碳酸氫根能微弱地電離為氫離子和碳酸根離子。故酸式鹽B的電離方程式:NaHCO3,,
故答案為:、;
⑤Na2O2由鈉離子和過氧根離子構(gòu)成,電子式:,
故答案為:;
⑥A.氧化鈉和酸反應(yīng)生成鹽和水、屬于堿性氧化物,過氧化鈉和酸反應(yīng)還有氧氣生成,且反應(yīng)過程中元素化合價發(fā)生變化、過氧化鈉不屬于堿性氧化物,故A錯誤;
B.氧化鈉和過氧化鈉均由離子構(gòu)成,在熔融狀況下均能導(dǎo)電,因此都屬于電解質(zhì),故B正確;
C.氧化鈉由鈉離子和氧離子構(gòu)成,過氧化鈉由鈉離子和過氧根離子構(gòu)成,兩者的陰陽離子個數(shù)比均為1:2,即正負(fù)離子個數(shù)比都為2比1,故C正確;
D.氧化鈉中只有離子鍵,過氧化鈉中既有離子鍵又有非極性鍵。所含化學(xué)鍵種類不完全相同,故D錯誤;
故答案為:BC。
⑦在8.2g 中含中子的個數(shù)為,
故答案為:4.4NA;
⑧A.16O2和18O2均為氧分子,不互為同位素,故A錯誤;
B.16O2和18O2均為氧分子,不互為同素異形體,故B錯誤;
C.18O的核電荷數(shù)為8、不是10,結(jié)構(gòu)示意圖錯誤,故C錯誤;
D.18O的最外層有6個電子,所給電子式正確,故D正確;
故答案為:C。
⑨與水反應(yīng),過氧化鈉中的氧化合價既升高又降低,水中的氧化合價不變,則化學(xué)方程式:2Na218O2+2H2O=2Na18OH+2NaOH+18O2↑,
故答案為:;
⑩如果將Na2O2投入到FeCl3溶液中,鈉與水先反應(yīng)生成氫氧化鈉和氫氣,后氫氧化鈉與氯化鐵反應(yīng)生成氫氧化鐵沉淀;
A.濁液分散質(zhì)的粒子直徑大于100nm之間,故A錯誤;
B.濁液和溶液均不能夠產(chǎn)生丁達(dá)爾現(xiàn)象,故B錯誤;
C.濁液的分散質(zhì)粒子難以透過濾紙和半透膜,故C正確;
D.濁液不穩(wěn)定,靜置片刻后,容器底部析出沉淀,故D錯誤;
故答案為:C。
A.金屬鈉與氧氣反應(yīng)的條件不同,產(chǎn)物也不同,常溫下得到氧化鈉,加熱下得到過氧化鈉,故A正確;
B.過氧化鈉與氧化鈉在空氣中長期放置,均與水反應(yīng)、均轉(zhuǎn)變?yōu)闅溲趸c,均進(jìn)一步轉(zhuǎn)變成為最終產(chǎn)物碳酸鈉,故B錯誤;
C.等物質(zhì)的量的氧化鈉與過氧化鈉置于等量的水中反應(yīng),根據(jù)Na2O+H2O=2NaOH、2Na2O2+2H2O=4NaOH+O2↑,消耗等量的水、生成等量的氫氧化鈉,則不考慮水汽揮發(fā),形成不飽和溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)相等,故C正確;
D.氧化鈉白色、過氧化鈉淡黃色,僅憑肉眼觀察,即可區(qū)分氧化鈉與過氧化鈉,故D錯誤;
故答案為:AC。
【點評】本題主要考查鈉的化學(xué)性質(zhì)等,注意完成此題,可以從題干中抽取有用的信息,結(jié)合已有的知識進(jìn)行解題。
4.(2025 閔行區(qū)模擬)氯化鐵(FeCl3)在水處理、金屬蝕刻、印染、有機(jī)合成等領(lǐng)域有著廣泛的應(yīng)用。
(1)如圖1所示,F(xiàn)eCl3溶液與Cu、C可形成原電池。Cu發(fā)生 氧化 反應(yīng),電子經(jīng)導(dǎo)線從 Cu 流向 C 。總反應(yīng)的化學(xué)方程式為 2Fe3++Cu = 2Fe2++Cu2+ 。
(2)實驗室用FeCl3 6H2O配制100mL0.200mol L﹣1FeCl3溶液,需要使用的玻璃儀器,除燒杯、玻璃棒外,還有 100mL容量瓶 、 膠頭滴管 。
(3)檢驗FeCl3溶液中Fe3+的試劑為 B 。(雙選)
A.氯水
B.KSCN溶液
C.NaOH溶液
D.FeCl2溶液
某同學(xué)向盛有FeCl3溶液的燒杯中加入CaCO3粉末,發(fā)現(xiàn)有無色氣泡產(chǎn)生。靜置24小時,可觀察到燒杯內(nèi)液體變?yōu)橥该鞯募t褐色,猜想得到了Fe(OH)3膠體。
(4)判斷Fe(OH)3膠體的最簡單方法為 丁達(dá)爾效應(yīng) 。
(5)此反應(yīng)的化學(xué)方程式為 3CaCO3+2FeCl3+3H2O=2Fe(OH)3(膠體)+3CO2↑+3CaCl2 。
(6)分離該紅褐色液體與燒杯底部石灰石的方法是 A 。
A.過濾
B.蒸餾
C.萃取分液
已知FeCl3遇水極易水解,原理是:2FeCl3+3H2O 2Fe(OH)3+3HCl,為了探究外界條件對氯化鐵水解平衡的影響,某興趣小組設(shè)計實驗方案,獲得如下數(shù)據(jù)(FeCl3的濃度為1mol L﹣1,忽略溶液體積的變化)。已知:pH數(shù)值越小,酸性越強(qiáng)。
實驗 V(FeCl3)/mL V(H2O)/mL n(NaCl)/mol n(Na2SO4)/mol 溫度/℃ pH
1 10 0 0 0 25 0.74
2 10 90 0 0 25 1.62
3 10 90 0 0 35 1.47
4 10 90 a 0 25 x
5 10 90 0 b 25 y
(7)實驗2和實驗3的目的是 探究溫度對氯化鐵水解平衡的影響 。
繼續(xù)查閱資料發(fā)現(xiàn),加入強(qiáng)電解質(zhì)后,由于溶液中離子總濃度增大,離子間的相互作用增強(qiáng),水解程度會改變。該興趣小組利用手持技術(shù)得到實驗4和實驗5的結(jié)果分別如圖2和圖3所示。
(8)根據(jù)實驗現(xiàn)象,提出假設(shè):
a.Cl﹣對Fe3+的水解有促進(jìn)作用;
b. 硫酸根離子對鐵離子的水解活性有抑制作用 。
(9)設(shè)計實驗證明假設(shè)a是否成立(寫出實驗操作、試劑、現(xiàn)象和結(jié)論) 向氯化鐵溶液中加入一定量的氯化鈉固體,若pH減小,說明假設(shè)a正確 。
【答案】(1)氧化;Cu;C;2Fe3++Cu = 2Fe2++Cu2+;
(2)100mL容量瓶;膠頭滴管;
(3)B;
(4)丁達(dá)爾效應(yīng);
(5)3CaCO3+2FeCl3+3H2O=2Fe(OH)3(膠體)+3CO2↑+3CaCl2;
(6)A;
(7)探究溫度對氯化鐵水解平衡的影響;
(8)硫酸根離子對鐵離子的水解活性有抑制作用;
(9)向氯化鐵溶液中加入一定量的氯化鈉固體,若pH減小,說明假設(shè)a正確。
【分析】(1)FeCl3溶液與Cu、C可形成原電池,銅失去電子為負(fù)極,Cu﹣2e﹣=Cu2+,碳極上三價鐵離子得電子為正極,電極方程式為Fe3++e﹣= Fe2+,據(jù)此解答;
(7)探究外界條件對氯化鐵水解平衡的影響,要控制變量,需要唯一變量,實驗2和實驗3的溫度不同,引起水解程度不同,導(dǎo)致pH變化,實驗4和實驗5分別加入氯化鈉和硫酸鈉,結(jié)合圖像pH變大,提出假設(shè)硫酸根離子對鐵離子的水解活性有抑制作用,若證明假設(shè)a成立,則其他條件一致,氯離子濃度越大,pH會減小,說明假設(shè)a正確,據(jù)此解答。
【解答】解:(1)FeCl3溶液與Cu、C可形成原電池,銅失去電子為負(fù)極,Cu﹣2e﹣=Cu2+,碳極上三價鐵離子得電子為正極,電極方程式為Fe3++e﹣= Fe2+,可知Cu失去電子發(fā)生氧化反應(yīng),電子經(jīng)導(dǎo)線從Cu流向C,總反應(yīng)的化學(xué)方程式為2Fe3++Cu = 2Fe2++Cu2+,
故答案為:氧化;Cu;C;2Fe3++Cu = 2Fe2++Cu2+;
(2)配制100mL0.200mol L﹣1FeCl3溶液,需要使用的玻璃儀器,除燒杯、玻璃棒外,還有100mL容量瓶、膠頭滴管,
故答案為:100mL容量瓶;膠頭滴管;
(3)Fe3+遇KSCN生成紅色物質(zhì),為Fe3+的特征反應(yīng),故用KSCN溶液檢驗Fe3+,
故答案為:B;
(4)判斷Fe(OH)3膠體的最簡單方法為丁達(dá)爾效應(yīng),用一束光照射液體,觀察到有光亮的通路,說明是膠體,
故答案為:丁達(dá)爾效應(yīng);
(5)根據(jù)題中現(xiàn)象可知FeCl3溶液與CaCO3反應(yīng)生成Fe(OH)3膠體,反應(yīng)的化學(xué)方程式為:3CaCO3+2FeCl3+3H2O=2Fe(OH)3(膠體)+3CO2↑+3CaCl2,
故答案為:3CaCO3+2FeCl3+3H2O=2Fe(OH)3(膠體)+3CO2↑+3CaCl2;
(6)分離該紅褐色液體即膠體與燒杯底部石灰石,方法是過濾,
故答案為:A;
(7)由表格中實驗2和實驗3的數(shù)據(jù)可知溫度不同,所以目的是探究溫度對氯化鐵水解平衡的影響,
故答案為:探究溫度對氯化鐵水解平衡的影響;
(8)由圖1知,加入強(qiáng)電解質(zhì)氯化鈉后pH減小,則促進(jìn)水解,對應(yīng)假設(shè)a:氯離子對鐵離子的水解活性有促進(jìn)作用;圖2中加入強(qiáng)電解質(zhì)硫酸鈉后pH增大,則對應(yīng)假設(shè)b,故可提出假設(shè):硫酸根離子對鐵離子的水解活性有抑制作用,
故答案為:硫酸根離子對鐵離子的水解活性有抑制作用;
(9)由于假設(shè)a是氯離子對鐵離子的水解活性有促進(jìn)作用,則設(shè)計的思路就是增加氯離子濃度,測量溶液的pH變化,故可向氯化鐵溶液中加入一定量的氯化鈉固體,若pH減小,說明假設(shè)a正確,
故答案為:向氯化鐵溶液中加入一定量的氯化鈉固體,若pH減小,說明假設(shè)a正確。
【點評】本題考查物質(zhì)的制備實驗,為高頻考點,把握物質(zhì)的性質(zhì)、流程中發(fā)生的反應(yīng)、物質(zhì)的制備原理為解答的關(guān)鍵,側(cè)重分析與實驗?zāi)芰Φ目疾椋⒁庠鼗衔镏R的應(yīng)用,題目難度中等。
5.(2025 虹口區(qū)二模)工業(yè)煙氣通常含有二氧化硫與氮氧化物,在排放前需經(jīng)脫硫脫硝處理。
如圖是“雙堿法”脫硫工藝路徑(部分產(chǎn)物已略)。
(1)反應(yīng)①常在吸收塔(結(jié)構(gòu)如圖所示)中進(jìn)行,為提高吸收效率,可采取的操作有 ACD 。(不定項)
A.煙氣從a口通入塔內(nèi)
B.增加煙氣流速
C.在塔內(nèi)填充堆積大量瓷環(huán)
D.NaOH溶液呈霧狀噴出
(2)若反應(yīng)①所得吸收液中Na2SO3與NaHSO3濃度相等。向該溶液中加入足量Ca(OH)2,用一個化學(xué)方程式表示反應(yīng)②: 2Na2SO3+2NaHSO3+3Ca(OH)2=3CaSO3↓+4NaOH+H2O 。
(3)反應(yīng)②完成后,將CaSO3濾出洗凈后用蒸餾水充分浸泡,沉降后測得上層液pH為8。已知25℃時,Ksp(CaSO3)=1.0×10﹣6。對上層液中相關(guān)離子濃度關(guān)系敘述正確的是 BCD 。(不定項)
A.[Ca2+]=[]=1.0×10﹣3mol L﹣1
B.
C.2[Ca2+]+[H+]=2[]+[]+[OH﹣]
D.[]+[H+]=[OH﹣]+2[H2SO3]
(4)僅用反應(yīng)①進(jìn)行脫硫的方法稱為“鈉堿法”。已知原料NaOH的價格為4.9元/kg,Ca(OH)2的價格為0.56元/kg,處理相同質(zhì)量的SO2,“雙堿法”所需的原料成本較“鈉堿法”更低,原因是 )“雙堿法”中NaOH溶液可循環(huán)使用,且沉淀時使用價格較低的Ca(OH)2,而“鈉堿法”直接用NaOH吸收SO2,NaOH價格較高且不能循環(huán)使用,所以處理相同質(zhì)量的SO2,“雙堿法”所需原料成本更低 。
NaClO溶液可用于煙氣脫硝。常溫下,調(diào)節(jié)NaClO溶液至不同pH,將煙氣以固定速率通過該吸收液,煙氣中的NO可轉(zhuǎn)化為NO3。測得NO去除率與吸收液pH關(guān)系如圖所示。
(5)已知煙氣中NO初始濃度為2.0×10﹣3g L﹣1,1L吸收液每分鐘可對500mL煙氣進(jìn)行脫硝處理。用溶液中濃度表示pH=8時的脫硝速率為 A mol L﹣1 min﹣1,(忽略吸收液體積變化)
A.2.5×10﹣5
B.5.0×10﹣5
C.1.5×10﹣3
D.3.0×10﹣3
(6)已知氧化性HClO>NaClO。當(dāng)吸收液pH>8時,NO去除率隨pH升高迅速下降的原因是 當(dāng)吸收液pH>8時,NaClO溶液中ClO﹣濃度增大,HClO濃度減小,而氧化性HClO>NaClO,HClO濃度減小導(dǎo)致氧化NO的能力下降,所以NO去除率隨pH升高迅速下降 。
科學(xué)家正著力研究用NH3—SCR反應(yīng)(NH3選擇性催化還原氮氧化物)對含NO的煙氣進(jìn)行脫硝,最終產(chǎn)物為無污染的N2和H2O,某種活性炭催化NH3—SCR脫硝的機(jī)理如下所示:
脫硝歷程 最高活化能Ea/kJ mol﹣1
階段①:2NO+O2═2NO2 118.9
階段②:2NO2+NH3═HNO3+NH2NO 19.1
階段③:HNO3+NO=NO2+HONO 105.3
階段④:NH2NO=N2+H2O 83.7
階段⑤:2HONO=NO2+NO+H2O 69.2
注:脫硝的每階段都包括若干基元反應(yīng),表中顯示的是該階段的總反應(yīng)以及各基元反應(yīng)活化能中數(shù)值最大的一個。
(7)根據(jù)上述反應(yīng)歷程可知NH3—SCR反應(yīng)的化學(xué)方程式為 D 。
A.4NH3+6NO5N2+6H2O
B.4NH3+3O22N2+6H2O
C.4NH3+2NO+2O23N2+6H2O
D.4NH3+4NO+O24N2+6H2O
(8)當(dāng)反應(yīng)溫度低于150℃時,隨著反應(yīng)進(jìn)行,NO的轉(zhuǎn)化率逐步下降,主要是因為催化劑表面出現(xiàn)白色固體沉積,覆蓋活性點位,該固體可能是 NH4NO3 。
(9)研究發(fā)現(xiàn),將煙氣中部分NO預(yù)先氧化為NO2后再進(jìn)行NH3—SCR反應(yīng),可明顯提升單位時間內(nèi)的脫硝率,結(jié)合上表數(shù)據(jù)解釋可能的原因 由表中數(shù)據(jù)可知,階段①的活化能較高,將部分NO預(yù)先氧化為NO2,可減少階段①反應(yīng),增加反應(yīng)歷程中活化能較低的反應(yīng),從而加快反應(yīng)速率,提升單位時間內(nèi)的脫硝率 。
【答案】(1)ACD;
(2)2Na2SO3+2NaHSO3+3Ca(OH)2=3CaSO3↓+4NaOH+H2O;
(3)BCD;
(4)“雙堿法”中NaOH溶液可循環(huán)使用,且沉淀時使用價格較低的Ca(OH)2,而“鈉堿法”直接用NaOH吸收SO2,NaOH價格較高且不能循環(huán)使用,所以處理相同質(zhì)量的SO2,“雙堿法”所需原料成本更低;
(5)A;
(6)當(dāng)吸收液pH>8時,NaClO溶液中ClO﹣濃度增大,HClO濃度減小,而氧化性HClO>NaClO,HClO濃度減小導(dǎo)致氧化NO的能力下降,所以NO去除率隨pH升高迅速下降;
(7)D;
(8)NH4NO3;
(9)由表中數(shù)據(jù)可知,階段①的活化能較高,將部分NO預(yù)先氧化為NO2,可減少階段①反應(yīng),增加反應(yīng)歷程中活化能較低的反應(yīng),從而加快反應(yīng)速率,提升單位時間內(nèi)的脫硝率。
【分析】(1)A.煙氣從a口通入塔內(nèi),與從上方進(jìn)入的NaOH溶液逆向接觸,能充分發(fā)生反應(yīng),提高吸收效率;
B.增加煙氣流速,會使煙氣與NaOH溶液接觸時間減少,降低吸收效率;
C.在塔內(nèi)填充堆積大量瓷環(huán),可增大煙氣與 NaOH 溶液的接觸面積,提高吸收效率;
D.NaOH 溶液呈霧狀噴出,能增大與煙氣的接觸面積,提高吸收效率;
(2)反應(yīng)①所得吸收液中Na2SO3與NaHSO3濃度相等,加入足量Ca(OH)2,Na2SO3、NaHSO3都與Ca(OH)2反應(yīng)生成CaSO3沉淀;
(3)A.在溶液中存在溶解平衡CaSO3(s) Ca2+(aq)(aq),Ksp(CaSO3)=[Ca2+][]=1.0×10﹣6,但由于會水解,所以[Ca2+]≠[]≠1.0×10﹣3mol/L;
B.的水解常數(shù)Kh1,HS的水解常數(shù)Kh2,因為Ka1>Ka2,所以Kh1>Kh2,即的水解程度大于HS,則;
C.根據(jù)電荷守恒,2[Ca2+]+[H+]=2[]+[HS]+[OH﹣];
D.根據(jù)質(zhì)子守恒,[]+[H+]=[OH﹣]+2[H2SO3];
(4)“雙堿法”中NaOH溶液可循環(huán)使用,且沉淀時使用價格較低的Ca(OH)2,而“鈉堿法”直接用NaOH吸收SO2,NaOH價格較高且不能循環(huán)使用,所以處理相同質(zhì)量的SO2,“雙堿法”所需原料成本更低;
(5)pH = 8時,NO去除率為50%,1L吸收液每分鐘處理500mL煙氣,NO初始濃度為2.0×10﹣3g/L,則轉(zhuǎn)化的NO的物質(zhì)的量為n(NO)1.67×10﹣5mol,根據(jù)3NO+H2O=2HNO3+NO,生成的物質(zhì)的量為n()n(NO)=1.11×10﹣5mol,因為忽略吸收液體積變化,所以用溶液中濃度表示的脫硝速率為:1.11×10﹣5mol/(L min)≈2.5×10﹣5mol L﹣1 min﹣1;
(6)當(dāng)吸收液pH>8時,NaClO溶液中ClO﹣濃度增大,HClO濃度減小,而氧化性HClO>NaClO,HClO濃度減小導(dǎo)致氧化NO的能力下降,所以NO去除率隨pH升高迅速下降;
(7)由反應(yīng)歷程可知,總反應(yīng)為4NH3+4NO+O24N2+6H2O;
(8)當(dāng)反應(yīng)溫度低于150℃時,催化劑表面出現(xiàn)白色固體沉積,覆蓋活性點位,根據(jù)反應(yīng)歷程可知,可能是HNO3與NH3反應(yīng)生成的NH4NO3;
(9)由表中數(shù)據(jù)可知,階段①的活化能較高,將部分NO預(yù)先氧化為NO2,可減少階段①反應(yīng),增加反應(yīng)歷程中活化能較低的反應(yīng),從而加快反應(yīng)速率,提升單位時間內(nèi)的脫硝率。
【解答】解:(1)A.煙氣從a口通入塔內(nèi),與從上方進(jìn)入的NaOH溶液逆向接觸,能充分發(fā)生反應(yīng),提高吸收效率,故A正確;
B.增加煙氣流速,會使煙氣與NaOH溶液接觸時間減少,降低吸收效率,故B錯誤;
C.在塔內(nèi)填充堆積大量瓷環(huán),可增大煙氣與 NaOH 溶液的接觸面積,提高吸收效率,故C正確;
D.NaOH 溶液呈霧狀噴出,能增大與煙氣的接觸面積,提高吸收效率,故D正確;
故答案為:ACD;
(2)反應(yīng)①所得吸收液中Na2SO3與NaHSO3濃度相等,加入足量Ca(OH)2,Na2SO3、NaHSO3都與Ca(OH)2反應(yīng)生成CaSO3沉淀,化學(xué)方程式為:2Na2SO3+2NaHSO3+3Ca(OH)2=3CaSO3↓+4NaOH+H2O,
故答案為:2Na2SO3+2NaHSO3+3Ca(OH)2=3CaSO3↓+4NaOH+H2O;
(3)A.在溶液中存在溶解平衡CaSO3(s) Ca2+(aq)(aq),Ksp(CaSO3)=[Ca2+][]=1.0×10﹣6,但由于會水解,所以[Ca2+]≠[]≠1.0×10﹣3mol/L,故A錯誤;
B.的水解常數(shù)Kh1,HS的水解常數(shù)Kh2,因為Ka1>Ka2,所以Kh1>Kh2,即的水解程度大于HS,則,故B正確;
C.根據(jù)電荷守恒,2[Ca2+]+[H+]=2[]+[HS]+[OH﹣],故C正確;
D.根據(jù)質(zhì)子守恒,[]+[H+]=[OH﹣]+2[H2SO3],故D正確;
故答案為:BCD;
(4)“雙堿法”中NaOH溶液可循環(huán)使用,且沉淀時使用價格較低的Ca(OH)2,而“鈉堿法”直接用NaOH吸收SO2,NaOH價格較高且不能循環(huán)使用,所以處理相同質(zhì)量的SO2,“雙堿法”所需原料成本更低,
故答案為:“雙堿法”中NaOH溶液可循環(huán)使用,且沉淀時使用價格較低的Ca(OH)2,而“鈉堿法”直接用NaOH吸收SO2,NaOH價格較高且不能循環(huán)使用,所以處理相同質(zhì)量的SO2,“雙堿法”所需原料成本更低;
(5)pH = 8時,NO去除率為50%,1L吸收液每分鐘處理500mL煙氣,NO初始濃度為2.0×10﹣3g/L,則轉(zhuǎn)化的NO的物質(zhì)的量為n(NO)1.67×10﹣5mol,根據(jù)3NO+H2O=2HNO3+NO,生成的物質(zhì)的量為n()n(NO)=1.11×10﹣5mol,因為忽略吸收液體積變化,所以用溶液中濃度表示的脫硝速率為:1.11×10﹣5mol/(L min)≈2.5×10﹣5mol L﹣1 min﹣1,(與選項A最接近),
故答案為:A;
(6)當(dāng)吸收液pH>8時,NaClO溶液中ClO﹣濃度增大,HClO濃度減小,而氧化性HClO>NaClO,HClO濃度減小導(dǎo)致氧化NO的能力下降,所以NO去除率隨pH升高迅速下降,
故答案為:當(dāng)吸收液pH>8時,NaClO溶液中ClO﹣濃度增大,HClO濃度減小,而氧化性HClO>NaClO,HClO濃度減小導(dǎo)致氧化NO的能力下降,所以NO去除率隨pH升高迅速下降;
(7)由反應(yīng)歷程可知,總反應(yīng)為4NH3+4NO+O24N2+6H2O,
故答案為:D;
(8)當(dāng)反應(yīng)溫度低于150℃時,催化劑表面出現(xiàn)白色固體沉積,覆蓋活性點位,根據(jù)反應(yīng)歷程可知,可能是HNO3與NH3反應(yīng)生成的NH4NO3,
故答案為:NH4NO3;
(9)由表中數(shù)據(jù)可知,階段①的活化能較高,將部分NO預(yù)先氧化為NO2,可減少階段①反應(yīng),增加反應(yīng)歷程中活化能較低的反應(yīng),從而加快反應(yīng)速率,提升單位時間內(nèi)的脫硝率,
故答案為:由表中數(shù)據(jù)可知,階段①的活化能較高,將部分NO預(yù)先氧化為NO2,可減少階段①反應(yīng),增加反應(yīng)歷程中活化能較低的反應(yīng),從而加快反應(yīng)速率,提升單位時間內(nèi)的脫硝率。
【點評】本題主要考查了化學(xué)平衡的有關(guān)知識,題目難度中等,掌握化學(xué)平衡的理論,結(jié)合題給信息,運用所學(xué)基礎(chǔ)知識是解答該題的關(guān)鍵。
6.(2025 浦東新區(qū)開學(xué))(1)煙氣脫硝是指通過一系列化學(xué)反應(yīng)將煙氣中的NO、NO2等氮的氧化物轉(zhuǎn)化為無污染的含氮物質(zhì)的過程。氧—氨水法是一種高效的工業(yè)脫硝技術(shù),主要流程圖如圖所示:
已知:O3+NO=NO2+O2;O3+2NO2=N2O5+O2。
①已知NO2為角形分子。下列關(guān)于NO、NO2說法正確的是 C 。
A.均屬于酸性氧化物
B.均屬于離子化合物
C.均屬于極性分子
D.均屬于電解質(zhì)
②靜電除塵的原理是含塵氣體經(jīng)高壓靜電場使塵粒帶電荷后,塵粒向帶相反電荷的電極定向移動,從而達(dá)到除塵目的。靜電除塵類似于膠體的 電泳 。
③X溶液中含有一種銨鹽,它由氨水與N2O5反應(yīng)生成,寫出反應(yīng)的離子方程式 。
④O3/NO摩爾比對NO脫除率以及NO2轉(zhuǎn)化率的影響如圖所示。分析最佳O3/NO摩爾比為 1.1 。
(2)脫硝反應(yīng)之一:2NO2(g)+O3(g) N2O5(g)+O2(g)ΔH<0,T℃時,向1.0L恒容密閉容器中充入2.0mol NO2和1.0mol O3,反應(yīng)過程中測定的部分?jǐn)?shù)據(jù)見表:
t/s 0 3 6 12 24
n(O2)/mol 0 0.36 0.60 0.80 0.80
①反應(yīng)在0~3s內(nèi)的平均速率v(NO2)= 0.24mol L﹣1 s﹣1 。
②下列描述中能說明上述反應(yīng)已達(dá)平衡的是 CD 。
A.混合氣體密度不再變化
B.單位時間內(nèi)消耗2mol NO2的同時生成1mol O2
C.v正(NO2)=2v逆(N2O5)
D.混合氣體壓強(qiáng)不再變化
③T℃時,上述脫硝反應(yīng)的化學(xué)平衡常數(shù)等于 20 。
④T℃時,若向上述容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,開始時反應(yīng) A 。
A.正向進(jìn)行
B.逆向進(jìn)行
C.達(dá)平衡
(3)如圖裝置能有效去除煙氣中的NO2,已知該電池反應(yīng)為:6NO2+8NH3=7N2+12H2O。
①A電極通過導(dǎo)線 A 電子。
A.流出
B.流入
②B電極的電極反應(yīng)式 。
(4)利用催化劑ZAg對NO催化轉(zhuǎn)化的反應(yīng)過程與能量變化如圖所示。
①下列說法正確的是 BC 。
A.高溫下有利于NO的轉(zhuǎn)化
B.由a釋放N2O的反應(yīng)速率最慢
C.a(chǎn)到b、d到e,都會形成非極性鍵
D.過渡態(tài)2比過渡態(tài)1穩(wěn)定
②寫出總反應(yīng)的熱化學(xué)方程式 2NO(g)=N2(g)+O2(g)ΔH=﹣182.8kJ mol﹣1 。
③判斷在上述實驗條件時該反應(yīng)是否會自發(fā)地進(jìn)行并說明判斷理由 由于反應(yīng)前后氣體分子數(shù)不變,ΔS很小(幾乎為0),而反應(yīng)的ΔH小于0,所以ΔH﹣TΔS<0,因此反應(yīng)可以自發(fā)進(jìn)行 。
(5)O2在一定條件下能有效去除煙氣中的NO,其可能的反應(yīng)機(jī)理如圖所示( OH表示羥基自由基,其中O元素為﹣1價, 表示未成對電子)。在 陽 (填“陰”或“陽”)極生成,在凈化器中生成1mol HNO3,消耗 OH的數(shù)目為 3NA 。
【答案】(1)①C;
②電泳;
③;
④1.1;
(2)①0.24mol L﹣1 s﹣1;
②CD;
③20;
④A;
(3)①A;
②;
(4)①BC;
②2NO(g)=N2(g)+O2(g) ΔH=﹣182.8kJ mol﹣1;
③由于反應(yīng)前后氣體分子數(shù)不變,ΔS很小(幾乎為0),而反應(yīng)的ΔH小于0,所以ΔH﹣TΔS<0,因此反應(yīng)可以自發(fā)進(jìn)行;
(5)陽;3NA。
【分析】(1)根據(jù)含NO、NO2的煙氣通過靜電除塵后,加入氨水同時通入臭氧氧化脫硝得到硝酸銨溶液,除霧后即為達(dá)標(biāo)排放的煙氣,靜電除塵的原理是含塵氣體經(jīng)高壓靜電場使塵粒帶電荷后,塵粒向帶相反電荷的電極定向移動,進(jìn)行分析;
(2)根據(jù)在一定條件下,當(dāng)一個可逆反應(yīng)的正反應(yīng)速率與逆反應(yīng)速率相等時,反應(yīng)物的濃度與生成物的濃度不再改變,即達(dá)到平衡狀態(tài),濃度商Q0.5<K=20,開始時反應(yīng)正向進(jìn)行進(jìn)行分析;
(3)根據(jù)反應(yīng)6NO2+8NH3=7N2+12H2O可知NH3失去電子作負(fù)極,NO2得到電子作正極生成N2,電極A為負(fù)極,電極B為正極,進(jìn)行分析;
(4)根據(jù)該反應(yīng)中,反應(yīng)物為NO(g),最終產(chǎn)物為N2(g)和O2(g),由于反應(yīng)前后氣體分子數(shù)不變,ΔS很小(幾乎為0),而反應(yīng)的ΔH小于0,所以ΔH﹣TΔS<0,因此反應(yīng)可以自發(fā)進(jìn)行,進(jìn)行分析;
(5)根據(jù)O2轉(zhuǎn)化為發(fā)生的反應(yīng)為O2﹣e﹣,故在陽極發(fā)生此反應(yīng);凈化器內(nèi)NO被HO 氧化為HNO3,發(fā)生的反應(yīng)為3HO +NO = HNO3+H2O,進(jìn)行分析。
【解答】解:(1)①A.NO不和H2O、NaOH反應(yīng),NO2和水發(fā)生氧化還原反應(yīng),二者都不是酸性氧化物,故A錯誤;
B.NO、NO2都屬于共價化合物,故B錯誤;
C.NO為直線形分子,NO2為角形分子,二者正負(fù)電中心不重合,都是極性分子,故C正確;
D.NO、NO2都屬于非電解質(zhì),故D錯誤;
故答案為:C;
②靜電除塵的原理是含塵氣體經(jīng)高壓靜電場使塵粒帶電荷后,塵粒向帶相反電荷的電極定向移動,從而達(dá)到除塵目的,類似于膠體的電泳,
故答案為:電泳;
③N2O5和水反應(yīng)生成HNO3,氨水與N2O5反應(yīng)生成硝酸銨,離子方程式為:2NH3 H2O+N2O5=22H2O,
故答案為:;
④由圖像可知,最佳摩爾比為1.1,此時NO的脫除率最大,且NO2的轉(zhuǎn)化率最高,
故答案為:1.1;
(2)①反應(yīng)在0~3s內(nèi)的平均速率v(NO2)=2v(O2)0.24mol L﹣1 s﹣1,
故答案為:0.24mol L﹣1 s﹣1;
②A.該反應(yīng)混合氣體的總質(zhì)量不變,為恒容密閉容器,則混合氣體密度一直保持不變,不能說明反應(yīng)達(dá)到平衡,故A錯誤;
B.單位時間內(nèi)消耗2mol NO2同時生成1mol O2都是指正反應(yīng)方向速率,不能說明反應(yīng)達(dá)到平衡,故B錯誤;
C.v正(NO2)=2v逆(N2O5)逆說明正逆反應(yīng)速率相等,反應(yīng)達(dá)到平衡狀態(tài),故C正確;
D.該反應(yīng)前后氣體分子總數(shù)不相等,則混合氣體壓強(qiáng)不再變化,說明反應(yīng)達(dá)到平衡狀態(tài),故D正確;
故答案為:CD;
③根據(jù)表格數(shù)據(jù)可知,達(dá)到平衡時,n(O2)=0.8mol,可知生成N2O50.8mol,消耗NO21.6mol,消耗O30.8mol,剩余NO20.4mol,剩余O30.2mol,容器體積1L,K20,
故答案為:20;
④T℃時,若向上述容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,此時濃度商Q0.5<K=20,開始時反應(yīng)正向進(jìn)行,
故答案為:A;
(3)①根據(jù)反應(yīng)6NO2+8NH3=7N2+12H2O可知NH3失去電子作負(fù)極,NO2得到電子作正極生成N2,電極A為負(fù)極,電極B為正極,A電極通過導(dǎo)線流出電子,
故答案為:A;
②根據(jù)反應(yīng)6NO2+8NH3=7N2+12H2O可知,電極B為正極,電極的電極反應(yīng)式,
故答案為:;
(4)①A.從圖中可以看出,NO催化轉(zhuǎn)化為N2和O2是一個放熱反應(yīng),則高溫下不利于NO的轉(zhuǎn)化,故A錯誤;
B.由a到c比由d到f的活化能大,活化能越大,反應(yīng)速率越慢,則由a釋放N2O的反應(yīng)速率最慢,故B正確;
C.a(chǎn)到b形成氮氮非極性鍵,由d到e形成氧氧非極性鍵,故C正確;
D.物質(zhì)具有的能量越高,穩(wěn)定性越差,圖中信息顯示,過渡態(tài)2的能量比過渡態(tài)1高,則過渡態(tài)2比過渡態(tài)1穩(wěn)定性差,故D錯誤;
故答案為:BC;
②該反應(yīng)中,反應(yīng)物為NO(g),最終產(chǎn)物為N2(g)和O2(g),反應(yīng)放出的能量為182.8kJ mol﹣1,則總反應(yīng)的熱化學(xué)方程式為2NO(g)=N2(g)+O2(g) ΔH=﹣182.8kJ mol﹣1,
故答案為:2NO(g)=N2(g)+O2(g) ΔH=﹣182.8kJ mol﹣1;
③該反應(yīng)前后氣體分子數(shù)都為2,ΔS接近0,ΔH=﹣182.8kJ mol﹣1<0,則上述實驗條件時該反應(yīng)會自發(fā)地進(jìn)行,理由:由于反應(yīng)前后氣體分子數(shù)不變,ΔS很小(幾乎為0),而反應(yīng)的ΔH小于0,所以ΔH﹣TΔS<0,因此反應(yīng)可以自發(fā)進(jìn)行,
故答案為:由于反應(yīng)前后氣體分子數(shù)不變,ΔS很小(幾乎為0),而反應(yīng)的ΔH小于0,所以ΔH﹣TΔS<0,因此反應(yīng)可以自發(fā)進(jìn)行;
(5)由圖可知,O2轉(zhuǎn)化為發(fā)生的反應(yīng)為O2﹣e﹣,故在陽極發(fā)生此反應(yīng);凈化器內(nèi)NO被HO 氧化為HNO3,發(fā)生的反應(yīng)為3HO +NO = HNO3+H2O,氮元素化合價由+2價升高到+5價,氧元素由﹣1價降低到﹣2價,則生成1mol HNO3,消耗 OH的數(shù)目為3NA,
故答案為:陽;3NA。
【點評】本題考查化學(xué)平衡,側(cè)重考查學(xué)生平衡移動的掌握情況,試題難度中等。
7.(2024秋 黃浦區(qū)校級期末)石油和煤不僅是人類使用最多的能源,也是重要的化學(xué)原料和寶貴的資源,它們是化工原料的兩大主要來源。
(1)下列石油分餾產(chǎn)品中,沸點范圍最高的是 A 。
A.瀝青
B.柴油
C.潤滑油
D.汽油
(2)下列過程不涉及化學(xué)變化的是 B 。
A.煤的氣化和液化
B.石油的分餾
C.石油的裂化、裂解
D.煤干餾
石油是多種烴類的混合物,回答下列烴類相關(guān)問題
(3)下列褪色過程是因為發(fā)生加成反應(yīng)而褪色的是 C 。
A.甲烷和氯氣混合光照后黃綠色消失
B.乙烯通入酸性高錳酸鉀溶液后溶液褪色
C.乙烯加入溴的四氯化碳溶液后,溶液褪色
D.將苯加入溴水中振蕩后水層接近無色
(4)同溫同壓下,1體積某氣態(tài)烴只能與1體積HCl氣體發(fā)生加成反應(yīng),生成氯代烷。1mol此氯代烷可與5mol Cl2發(fā)生完全的取代反應(yīng),則該烴的結(jié)構(gòu)簡式為 B 。
A.CH3CH=CH2
B.CH2=CH2
C.CH3CH3
D.CH3CH2CH=CH2
(5)標(biāo)準(zhǔn)狀況下,4.48升氣態(tài)混合烴在足量氧氣中完全燃燒后得到6.72升二氧化碳和7.2克水,則下列對氣態(tài)混合烴的描述正確的是 CD 。
A.一定含乙烷
B.一定含乙烯
C.一定含甲烷
D.可能含乙烯
【答案】(1)A。
(2)B。
(3)C。
(4)B。
(5)CD。
【分析】(1)根據(jù)沸點:石油氣<汽油<煤油<柴油<重柴油<潤滑油<凡士林<石蠟<瀝青,進(jìn)行分析;
(2)根據(jù)沒有新物質(zhì)生成,屬于物理變化,進(jìn)行分析;
(3)根據(jù)乙烯加入溴的四氯化碳溶液后,溶液褪色,發(fā)生加成反應(yīng),溶液褪色,溴在苯中溶解度比水中大,甲烷和氯氣混合光照后發(fā)生取代反應(yīng)生成氯代甲烷的混合物和HCl,進(jìn)行分析;
(4)根據(jù)1體積某氣態(tài)烴只能與1體積HCl氣體發(fā)生加成反應(yīng),說明該物質(zhì)含有一個碳碳雙鍵,生成氯代烷,進(jìn)行分析;
(5)根據(jù)n(氣態(tài)混合烴):n(C):n(H)=0.2mol:0.3mol:0.8mol=1:1.5:4,則烴的化學(xué)式為C1.5H4,進(jìn)行分析。
【解答】解:(1)將石油常壓分餾依次得到石油氣、汽油、煤油、柴油、重油等,將重油減壓分餾依次得到重柴油、潤滑油、凡士林、石蠟、瀝青,則它們的沸點范圍由低到高的順序為:石油氣<汽油<煤油<柴油<重柴油<潤滑油<凡士林<石蠟<瀝青,
故答案為:A。
(2)A.煤經(jīng)過氣化生成水煤氣;液化生成甲醇等液體燃料,均屬于化學(xué)變化,故A錯誤;
B.石油的分餾是根據(jù)各物質(zhì)沸點的不同來實現(xiàn)物質(zhì)分離的方法,沒有新物質(zhì)生成,屬于物理變化,故B正確;
C.石油的裂化和裂解是在一定的條件下,將相對分子質(zhì)量較大、沸點較高的烴斷裂為相對分子質(zhì)量較小、沸點較低的烴的過程,屬于化學(xué)變化,故C錯誤;
D.煤的干餾是將煤隔絕空氣加強(qiáng)熱使其分解的過程,有新物質(zhì)生成,屬于化學(xué)變化,故D錯誤;
故答案為:B。
(3)A.甲烷和氯氣混合光照后發(fā)生取代反應(yīng)生成氯代甲烷的混合物和HCl,黃綠色消失,故A錯誤;
B.乙烯含有碳碳雙鍵,能被酸性高錳酸鉀溶液氧化,乙烯通入酸性高錳酸鉀溶液后溶液褪色,是發(fā)生了氧化反應(yīng),故B錯誤;
C.乙烯加入溴的四氯化碳溶液后,溶液褪色,發(fā)生加成反應(yīng),溶液褪色,故C正確;
D.溴在苯中溶解度比水中大,將苯加入溴水中振蕩后水層接近無色,水中的溴被萃取到苯中,是物理過程,故D錯誤;
故答案為:C。
(4)1體積某氣態(tài)烴只能與1體積HCl氣體發(fā)生加成反應(yīng),說明該物質(zhì)含有一個碳碳雙鍵,生成氯代烷,1mol此氯代烷可與5mol Cl2發(fā)生完全的取代反應(yīng),說明此氯代烷含有5個H原子,符合條件的是CH2=CH2,故B正確,
故答案為:B。
(5)標(biāo)準(zhǔn)狀況下,4.48L氣態(tài)混合烴的物質(zhì)的量為0.2mol,生成6.72L二氧化碳的物質(zhì)的量為0.3mol,7.2g水的物質(zhì)的量為0.4mol,則n(氣態(tài)混合烴):n(C):n(H)=0.2mol:0.3mol:0.8mol=1:1.5:4,則烴的化學(xué)式為C1.5H4,從C原子個數(shù)來說,混合物中一定含有甲烷,從H原子個數(shù)來說,可能含有乙烯或丙炔一種或兩種,或是甲烷、乙炔、其他氣態(tài)烴混合氣體,故CD正確,
故答案為:CD。
【點評】本題主要考查石油的裂化和裂解等,注意完成此題,可以從題干中抽取有用的信息,結(jié)合已有的知識進(jìn)行解題。
8.(2024春 寶山區(qū)校級期末)自然界和人工合成的物質(zhì)中,絕大多數(shù)是有機(jī)化合物。有機(jī)化合物種類繁多,性質(zhì)各異,與我們的生活、生產(chǎn)密切相關(guān)。其中煤、石油、天然氣為人類生產(chǎn)生活提供能量。請根據(jù)要求回答問題!
(1)石油的分餾是 物理 (填“物理”或“化學(xué)”)變化。
(2)下列石油分餾產(chǎn)品中,沸點范圍最低的是 C 。
A.瀝青
B.汽油
C.石油氣
D.柴油
(3)某石化廠獲得大量乙烯、丙烯、丁二烯采用的方法是 C 。
A.石油的分餾
B.煤的干餾
C.石油的裂解
D.煤的氣化
(4)下列有關(guān)有機(jī)化合物說法正確的是 C 。
A.凡有甜味的有機(jī)化合物均屬于糖類
B.尼龍是天然高分子材料
C.蛋白質(zhì)、油脂、糖類是三大基本營養(yǎng)物質(zhì)
(5)既可以用來鑒別乙烷與乙烯,又可以用來除去乙烷中的乙烯的方法是 B 。
A.通過足量的NaOH溶液
B.通過溴的CCl4溶液
C.在Ni催化、加熱條件下通入過量H2
D.通過足量的酸性KMnO4溶液
糖類、油脂、蛋白質(zhì)是生命活動的物質(zhì)和能量基礎(chǔ)。淀粉是重要的營養(yǎng)物質(zhì),在大米、小麥、馬鈴薯中大量存在.淀粉在一定條件下可以水解生成葡萄糖,人體中葡萄糖在酶的作用下緩慢氧化,釋放能量以保證生命活動正常運行。以淀粉為主要原料,合成高分子化合物B和一種具有果香味的有機(jī)物C,合成路線如圖。
(6)A分子內(nèi)含有的官能團(tuán)是 碳碳雙鍵 (填名稱)。
(7)反應(yīng)Ⅰ的反應(yīng)類型: 加聚反應(yīng) ;反應(yīng)Ⅲ的反應(yīng)類型: 取代反應(yīng)(或酯化反應(yīng)) ;
(8)檢驗有化合物乙酸生成所需試劑是 C
A.酸性高錳酸鉀溶液
B.希夫試劑
C.碳酸氫鈉溶液
(9)寫出下列反應(yīng)的化學(xué)方程式:Ⅱ 2CH3CH2OH+O22CH3CHO+2H2O ;Ⅲ CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O 。
【答案】(1)物理;
(2)C;
(3)C;
(4)C;
(5)B;
(6)碳碳雙鍵;
(7)加聚反應(yīng);取代反應(yīng)(或酯化反應(yīng));
(8)C;
(9)2CH3CH2OH+O22CH3CHO+2H2O;CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O。
【分析】(1)沒有生成新物質(zhì)的變化屬于物理變化,反之,為化學(xué)變化;
(2)相對分子質(zhì)量最小,沸點最低;
(3)石油的裂解可以獲得大量乙烯、丙烯等短鏈不飽和烴;
(4)A.有甜味的有機(jī)化合物不一定屬于糖類,反之,糖類不一定有甜味;
B.尼龍是合成的高分子材料;
C.蛋白質(zhì)、油脂、糖類是基本營養(yǎng)物質(zhì);
(5)A.乙烷與乙烯都不與NaOH溶液反應(yīng);
B.乙烯可以與溴的CCl4溶液反應(yīng),生成1,2﹣二溴乙烷;
C.過量H2會引入新的雜質(zhì);
D.酸性KMnO4溶液可以把乙烯氧化為CO2會引入新的雜質(zhì);
(6)~(9)淀粉在稀硫酸的作用下,加熱,水解,生成葡萄糖,葡萄糖在酒化酶的作用下,生成乙醇和CO2,乙醇在濃硫酸、170℃的條件下,發(fā)生消去反應(yīng),生成乙烯,乙烯發(fā)生加聚反應(yīng),生成聚乙烯,乙醇發(fā)生催化氧化,生成乙醛,乙醛繼續(xù)氧化,生成乙酸,乙醇一會兒乙酸發(fā)生酯化反應(yīng),生成乙酸乙酯,據(jù)此分析作答。
【解答】解:(1)石油的分餾是利用物質(zhì)的沸點的不同,將其分為若干餾分,沒有生成新物質(zhì),屬于物理變化,
故答案為:物理;
(2)石油氣的相對分子質(zhì)量最小,沸點范圍最低,即B符合題意,
故答案為:C;
(3)某石化廠獲得大量乙烯、丙烯、丁二烯采用的方法是石油的裂解,
故答案為:C;
(4)A.凡有甜味的有機(jī)化合物不一定屬于糖類,反之,有的糖類不一定有甜味,故A錯誤;
B.尼龍是合成的高分子材料,故B錯誤;
C.蛋白質(zhì)、油脂、糖類是三大基本營養(yǎng)物質(zhì),故C正確;
故答案為:C;
(5)A.乙烷與乙烯都不與NaOH溶液反應(yīng),故A錯誤;
B.乙烯可以與溴的CCl4溶液反應(yīng),生成1,2﹣二溴乙烷,既可以用來鑒別乙烷與乙烯,又可以用來除去乙烷中的乙烯,故B正確;
C.在Ni催化、加熱條件下,向乙烷與乙烯中通入過量H2,可以除去乙烯,但氫氣過量,又會引入新的雜質(zhì),故C錯誤;
D.酸性KMnO4溶液可以把乙烯氧化為CO2,故酸性KMnO4溶液可以鑒別乙烷與乙烯,但不能除去乙烷中的乙烯,故D錯誤;
故答案為:B;
(6)由圖可知,A為乙烯,分子內(nèi)含有的官能團(tuán)是碳碳雙鍵,
故答案為:碳碳雙鍵;
(7)由圖可知,反應(yīng)Ⅰ為乙烯發(fā)生加聚反應(yīng),生成聚乙烯,反應(yīng)Ⅲ為乙醇與乙酸發(fā)生酯化反應(yīng)生成乙酸乙酯,酯化反應(yīng)的本質(zhì)屬于取代反應(yīng),
故答案為:加聚反應(yīng);取代反應(yīng)(或酯化反應(yīng));
(8)A.乙醇、乙醛、乙酸都能使酸性高錳酸鉀溶液褪色,故A錯誤;
B.希夫試劑與醛類物質(zhì)作用,顯紫紅色,可以用來鑒別醛類物質(zhì),故B錯誤;
C.乙醇、乙醛與碳酸氫鈉溶液不反應(yīng),乙酸可以與其反應(yīng),放出CO2氣體,故C正確;
故答案為:C;
(9)反應(yīng)Ⅱ的化學(xué)方程式為:2CH3CH2OH+O22CH3CHO+2H2O;反應(yīng)Ⅲ的化學(xué)方程式為:CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,
故答案為:2CH3CH2OH+O22CH3CHO+2H2O;CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O。
【點評】本題主要考查石油的分餾、裂解的概念,乙烷與乙烯的鑒別與除雜,常見有機(jī)物的性質(zhì)等,屬于基本知識的考查,難度不大。
21世紀(jì)教育網(wǎng) www.21cnjy.com 精品試卷·第 2 頁 (共 2 頁)
21世紀(jì)教育網(wǎng)(www.21cnjy.com)
展開更多......
收起↑
 資源預(yù)覽
資源預(yù)覽