資源簡介
資源簡介
上海市青浦高級中學2024學年第二學期期末質量檢測
高二化學試卷
說明:1.考試時間60分鐘,滿分100分。
2標注“不定項”的,有1“2個正確選項,未標注的為單選。
3.相對原子質量:C-12N-14Cu64K-39F0-560-16
一、多姿多彩的過渡金屬
過渡金屬因具有良好理化特性,在國防、軍事、科技、工農業生產等眾多領域都有很重要的用
途。回答下列問題:
1.過渡金屬處于元素周期表的區。
2.金屬銅Cu在周期表中的位置是
3.基態銅原子的價電子所占軌道數為
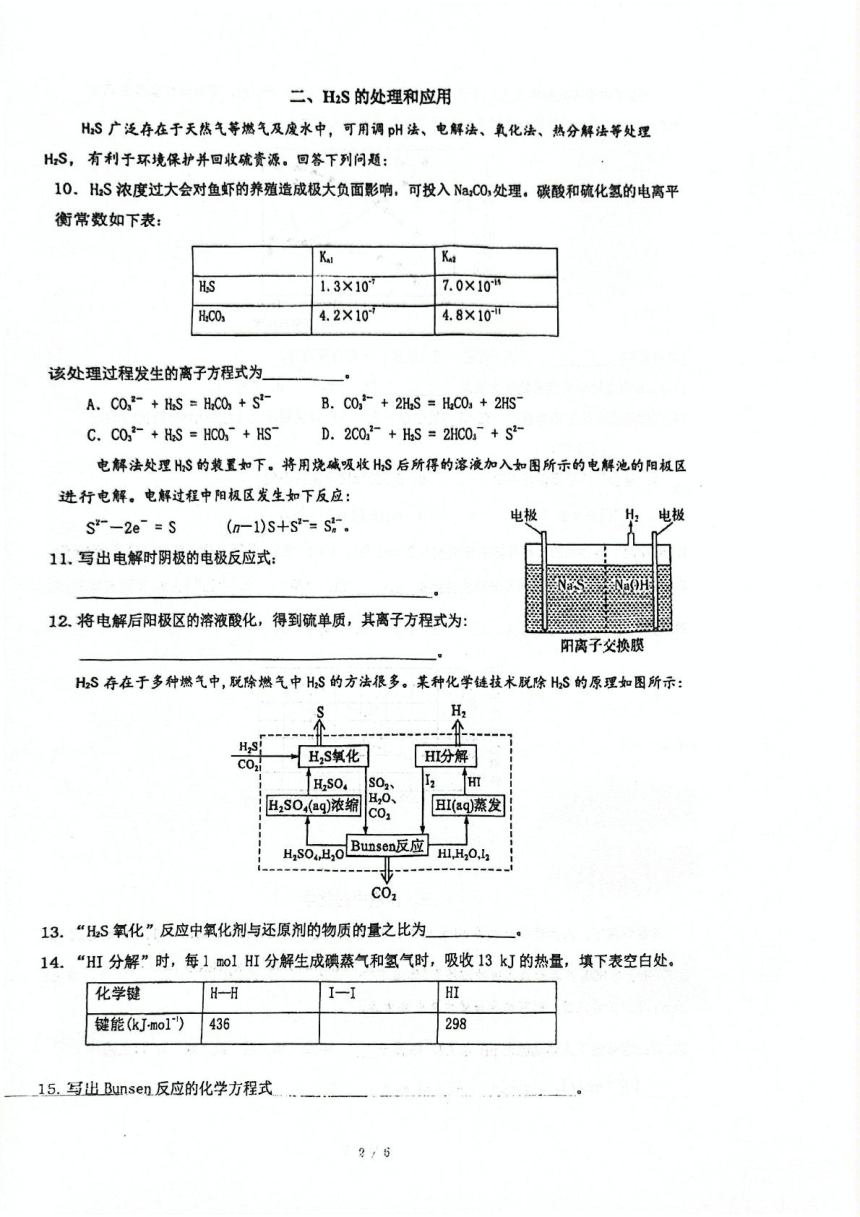
4.古埃及人很早就開始利用含鈷礦石制作顏料。K[CoN0)]是一種黃色顏料,中心離子是
,其配體的VSEPR的結構模型為
利用丁二酮肪與鎳離子形成有色絡合物(丁二酮肟鎳,結構如圖所示),可在實驗室中檢驗
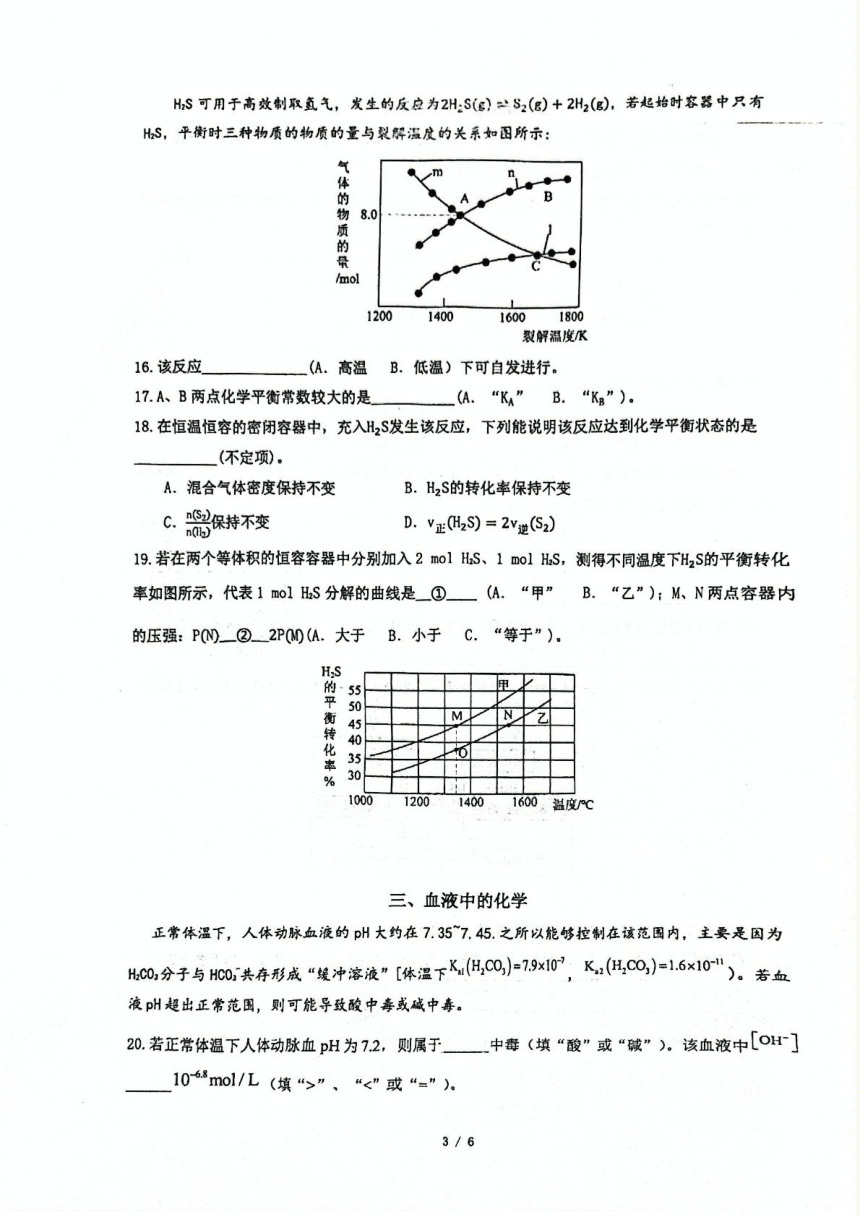
N2+。
5.該化合物中第二周期非金屬元素按第一電離能由小到大的順序
H.C
CH.
為
0
6.下列有關說法正確的是()(不定項)
A,該物質的分子內存在共價鍵、配位鍵、氫鍵等化學鍵
B.該物質是一種配合物,其中Ni離子為中心離子
C.該物質的分子中C、N、O原子均存在孤電子對
D.該物質的分子中C原子的雜化類型有$p2、s即32種
某含Cu的晶體晶胞結構如圖所示。該晶胞中負離子為CN(部分示例位置已用箭頭標出),C州
連接著每一對相鄰的Fe”與Cu“。已知該晶胞棱長為am,M為阿伏加德羅常數的值。
(已知:1nm=1*10'cm)
7.該晶胞中距Cu最近且等距的K有
個。
8.該晶體的化學式為
9.晶體密度為
g.cm3(列出代數式)。
●Gu24
K
1/6
二、HS的處理和應用
HS廣泛存在于天然氣等燃氣及廢水中,可用調p州法、電解法、氧化法、熱分解法等處理
HS,有利于環境保護并回收硫資源。回答下列問題:
10.HS濃度過大會對魚蝦的養殖造成極大負面彩響,可投入NC0處理。碳酸和疏化氫的電離平
衡常數如下表:
K
Ka
HS
1.3×10
7.0X10w
H:CO
4.2×10
4.8×10m
該處理過程發生的離子方程式為】
0
A.C02-+hS=H00,+S2-
B.CO,+2HaS H:CO 2HS-
C.CO+H2S HCO+HS
D.2C02-+HS=2HC0:+S2
電解法處理HS的裝置如下。將用燒堿吸收HS后所得的溶液加入如圖所示的電解池的陽極區
進行電解。電解過程中陽極區發生如下反應:
電極
S*--2e=S
(n-1)S+S2-=S.
電極
11.寫出電解時陰極的電極反應式:
12.將電解后陽極區的溶液酸化,得到硫單質,其離子方程式為:
陽離子父換膜
H2S存在于多種燃氣中,脫除燃氣中HS的方法很多。某種化學鏈技術脫除HS的原理如圖所示:
CO,
HS氧化
H分懈
H2SO
S02
m
H2S0,(aq)濃縮
H20、
C01
HI(aq蒸發
H,s0,H,Buns0n反應,i,0.,
C02
13.“HS氧化”反應中氧化劑與還原劑的物質的量之比為
14.“HT分解”時,每1olH肛分解生成碘蒸氣和氫氣時,吸收13kJ的熱量,填下表空白處。
化學鍵
H-
I一I
HI
鍵能(kJ-mol)
436
298
15.寫出Bunsen.反應的化學方程式
216
展開更多......
收起↑
 資源預覽
資源預覽