資源簡介
資源簡介
2025年中考考前最后一卷
化學(徐州卷)
(滿分120分,考試用時120分鐘)
注意事項:
1.答卷前,考生務必將自己的姓名、準考證號填寫在答題卡上。
2.作答選擇題時,選出每小題答案后,用 2B 鉛筆把答題卡上對應題目選項的答案信息點涂黑;如需改動,用橡皮擦干凈后,再選涂其他答案,答案不能答在試卷上。
3.非選擇題必須用黑色字跡的鋼筆或簽字筆作答,答案必須寫在答題卡各題目指定區域內相應位置上;如需改動,先劃掉原來的答案,然后再寫上新的答案;不準使用鉛筆和涂改液。不按以上要求作答的答案無效。
4.考試結束后,將本試卷和答題卡一并交回。
可能用到的相對原子質量:H 1 C 12 N 14 O 16Na 23 S 32
一、選擇題(本大題共 12 小題,每小題 3 分,共 36 分。每小題只有一個選項符合題意,請將符合題意的選項用2B 鉛筆填涂在答題卡相應位置)
1.五谷豐登,社稷安寧。“五谷”中主要富含的營養物質是
A.油脂 B.糖類 C.維生素 D.蛋白質
2.一般情況下,兩種活動性不同的金屬在潮濕的環境中接觸時,活動性強的金屬首先被腐蝕。為了避免輪船的鋼質外殼被腐蝕,通常在輪船外殼上鑲嵌的金屬是( )
A.鋅板 B.銀板 C.銅板 D.鉛板
3.下面是從性質、類別、構成、變化等角度認識物質的思維導圖。下列說法正確的是
A.濃硫酸具有揮發性 物質 B.同種元素組成的物質一定是單質
C.工業上制取氧氣時,分子種類改變 D.NaCl由Na+和Cl-構成
4.某同學在實驗室配制10%NaOH溶液的部分操作如下,其中正確的是
A.取用NaOH_______ B.稱量 NaOH_______ C.量取所需的水 D.配制溶液
5.“拉風箱,夯鐵錘”,三國名士嵇康留下“柳下鍛鐵”的典故。下列說法不合理的是
A.風箱拉動過程為燃燒增加了可燃物
B.拉風箱時火爐中的溫度維持在煤的著火點之上
C.火爐中的藍色火焰是一氧化碳燃燒產生的
D.“鍛鐵”的目的是降低生鐵中的含碳量
閱讀下列材料,完成6~7小題:
碳酸鈉有著廣泛的應用。海水曬鹽后精制得到氯化鈉,電解飽和氯化鈉溶液可得到氯氣(Cl2)和氫氧化鈉。以氯化鈉、氨氣、二氧化碳等為原料可制得碳酸氫鈉,碳酸氫鈉固體受熱分解生成碳酸鈉。
6.下列關于鈉的化合物的性質與用途具有對應關系的是
A.氯化鈉是白色固體,可用作食品防腐劑
B.氫氧化鈉具有強堿性,可用作干燥劑
C.碳酸氫鈉受熱易分解,可用于治療胃酸過多
D.碳酸鈉溶液呈堿性,可用于去除油污
7.下列有關碳酸鈉制備的說法正確的是
A.海水曬鹽主要發生化學變化 B.電解氯化鈉溶液時,化學能轉化為電
C.所得副產物氯化銨可作氮肥 D.碳酸鈉固體受熱易分解
8.實現“雙碳”是我國高質量發展的必然要求,將CO2轉化為甲烷是減碳的研究方向之一,該反應的微觀示意圖如圖所示。下列說法不正確的是
A.反應前后,分子種類發生改變
B.該反應中CO2是氧化劑
C.參加反應的兩種分子個數比為1:4
D.反應前后各元素的化合價均沒有改變
9.除去下列物質中混有的少量雜質(括號內為雜質),擬定的實驗方案可行的是
A.CaCO3固體(CaO)——高溫充分煅燒
B.N2氣體(O2)——緩緩通過足量的灼熱的氧化銅
C.CO2氣體(HCl)——依次通過足量的碳酸氫鈉溶液和濃硫酸
D.Na2SO4溶液(MgSO4)——依次加入過量的氫氧化鈉溶液和稀硫酸
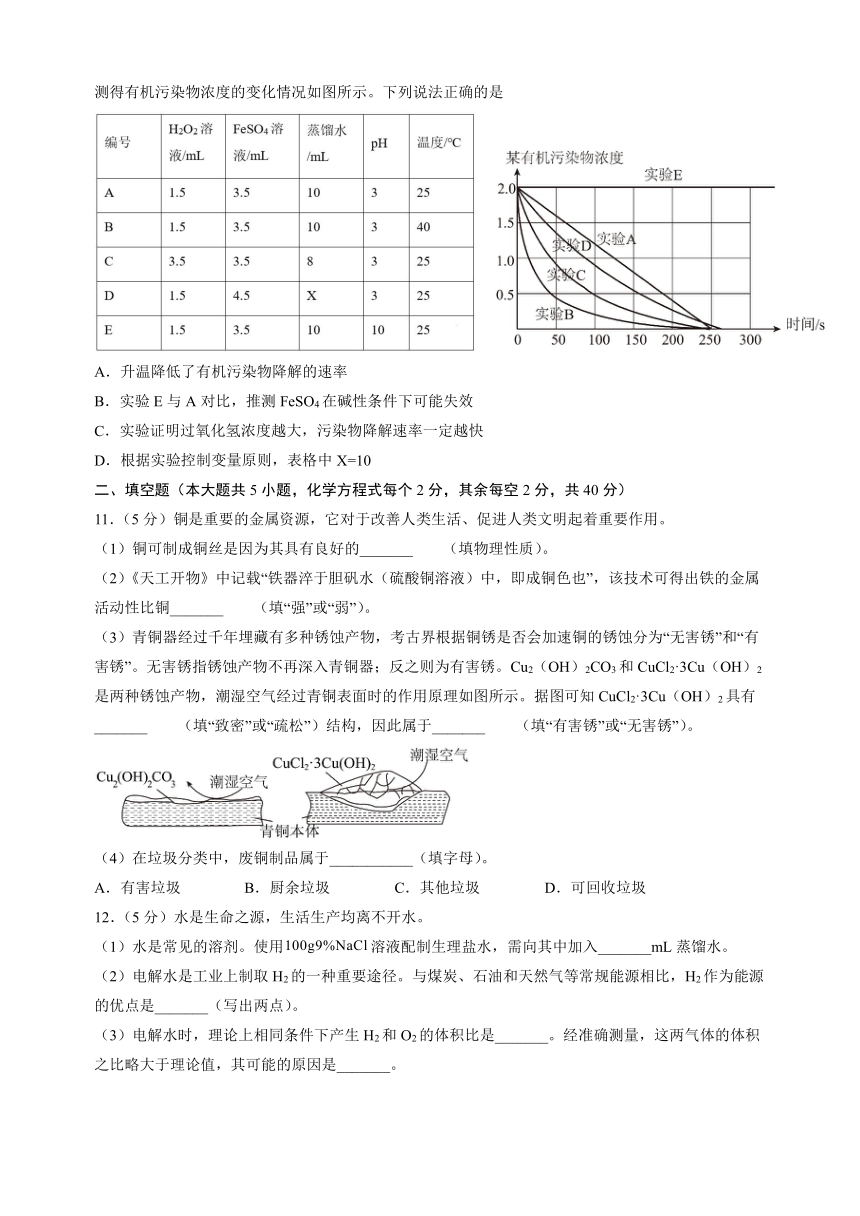
10.實驗室探究某有機污染物降解速率的影響因素,用一定濃度的H2O2和FeSO4溶液按表進行實驗,測得有機污染物濃度的變化情況如圖所示。下列說法正確的是
A.升溫降低了有機污染物降解的速率
B.實驗E與A對比,推測FeSO4在堿性條件下可能失效
C.實驗證明過氧化氫濃度越大,污染物降解速率一定越快
D.根據實驗控制變量原則,表格中X=10
二、填空題(本大題共5小題,化學方程式每個2分,其余每空2分,共40分)
11.(5分)銅是重要的金屬資源,它對于改善人類生活、促進人類文明起著重要作用。
(1)銅可制成銅絲是因為其具有良好的_______ (填物理性質)。
(2)《天工開物》中記載“鐵器淬于膽礬水(硫酸銅溶液)中,即成銅色也”,該技術可得出鐵的金屬活動性比銅_______ (填“強”或“弱”)。
(3)青銅器經過千年埋藏有多種銹蝕產物,考古界根據銅銹是否會加速銅的銹蝕分為“無害銹”和“有害銹”。無害銹指銹蝕產物不再深入青銅器;反之則為有害銹。Cu2(OH)2CO3和CuCl2·3Cu(OH)2是兩種銹蝕產物,潮濕空氣經過青銅表面時的作用原理如圖所示。據圖可知CuCl2·3Cu(OH)2具有_______ (填“致密”或“疏松”)結構,因此屬于_______ (填“有害銹”或“無害銹”)。
(4)在垃圾分類中,廢銅制品屬于___________(填字母)。
A.有害垃圾 B.廚余垃圾 C.其他垃圾 D.可回收垃圾
12.(5分)水是生命之源,生活生產均離不開水。
(1)水是常見的溶劑。使用溶液配制生理鹽水,需向其中加入_______mL蒸餾水。
(2)電解水是工業上制取H2的一種重要途徑。與煤炭、石油和天然氣等常規能源相比,H2作為能源的優點是_______(寫出兩點)。
(3)電解水時,理論上相同條件下產生H2和O2的體積比是_______。經準確測量,這兩氣體的體積之比略大于理論值,其可能的原因是_______。
(4)工業上還能以CH4為原料制取H2,主要發生的反應有:,。與電解水法制取H2相比,該方法存在的不足是_______。
13.(10分)晾曬海水所得到的粗鹽中含有不溶性雜質(泥沙)和可溶性雜質。下圖是某化學小組在實驗室對粗鹽中可溶性雜質(CaCl2、MgCl2、Na2SO4)的去除過程。
(1)寫出加入適量鹽酸的目的是_______ 。
(2)固體甲除了Mg(OH)2、BaSO4外還有_______ (寫化學式);操作I需要的玻璃儀器除了漏斗、燒杯外還有_______。
(3)用化學方程式表示加入碳酸鈉溶液的目的是_______ 。
(4)(5分)某工廠利用氫氧化鈉溶液捕集吸收CO2。若要吸收8.8噸CO2,至少需要含氫氧化鈉質量分數為32%的氫氧化鈉溶液多少噸
14.(9分)氫能是一種清潔能源,氫氣的制備方法受到廣泛的關注和研究。
(一)實驗室用鋅粒和稀硫酸反應制取H2.
(1)反應的化學方程式為_______ ,屬于反應類型。
(2)下列儀器中,制備并收集H2時不需要選用的是_______ (填字母),儀器M的名稱為_______ 。
(二)暗發酵制氫是生物制氫的一種方法,溫度在40-60℃為宜。揚州地區主要糧食作物為小麥和水稻,小麥和水稻的秸稈中木質素緊密包圍纖維素,纖維素在暗發酵細菌和酶的作用下先轉化為葡萄糖,葡萄糖再轉化為甲酸、乙醇等,最后轉化為氫氣。
Ⅰ.用小麥和水稻的秸稈為發酵物進行暗發酵制氫實驗,產氫量和能量轉化率如表所示。
發酵物 木質素/% 產氫量/mL 能量轉化率/%
小麥秸稈 22.1 292 5.2
水稻秸稈 17.3 446 6.1
(3)由表可知,與小麥秸稈相比,水稻秸稈作為發酵物的優點是_______ ;小麥秸稈暗發酵產氫量低的原因是_______ 。
(4)甲酸(HCOOH)在氫化酶的催化下生成CO2和H2反應的化學方程式為_______ 。
16.(11分)我國著名化學家侯德榜先生創立了侯氏制堿法,反應原理為:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。將NaHCO3經洗滌、加熱生成純堿。化學小組在實驗室模擬侯氏制堿法制取純堿,進行項目化學習。試回答下列問題:
任務一:制備碳酸鈉
(1)配制飽和食鹽水。(NH4Cl、NaCl和NaHCO3溶解度曲線如圖)20℃時,100g水中需加入_______ gNaCl。
(2)室溫下,該過程能析出NaHCO3晶體的原因是_______ 。
(3)如圖中碳酸氫鈉的溶解度在60℃后無數據的原因可能是_______ 。
(4)該反應在獲得NaHCO3的同時,也生成了NH4Cl,其中NH4Cl在農業生產中可作_______ 肥。
任務二:產品應用
(5)工業上可用純堿和熟石灰反應制取氫氧化鈉,反應的化學方程式為_______ 。
(6)NaHCO3和Na2CO3水溶液均呈堿性。其中NaHCO3是治療胃酸過多癥的一種抗酸藥。Na2CO3是否適合作為抗酸藥呢?
【查閱資料】
Ⅰ.人體胃液(含有鹽酸)通常約100mL,pH約1.5,體溫約37℃。
Ⅱ.抗酸藥的標準之一:藥物發生療效時,胃液的pH保持在3~5之間最宜,pH過高會導致胃痛等不適癥狀。
【提出猜想】
①猜想甲:Na2CO3適合作為抗酸藥。其理由是_______ (用化學方程式表示)。
猜想乙:Na2CO3不適合作為抗酸藥。其原因可能是堿性較強。
【實驗探究1】探究Na2CO3與NaHCO3堿性的強弱
②依次測量等濃度的Na2CO3溶液和NaHCO3溶液的pH,結果分別為11和8。Na2CO3溶液的堿性比NaHCO3溶液_______ (填“強”或“弱”)。
【實驗探究2】探究Na2CO3作為抗酸藥的適應性
利用圖1進行實驗。向燒瓶中加入100mLpH為1.5的鹽酸,打開恒壓滴液漏斗,向燒瓶中以1mL/min的速度滴入pH為1.5的鹽酸模擬人體分泌的胃液,再加入1g Na2CO3固體,并持續攪拌。用pH傳感器記錄溶液pH隨時間的變化曲線。將上述實驗中Na2CO3換成NaHCO3,重復實驗過程。所得兩條曲線如圖2所示。
【得出結論】
③分析數據,得出結論。與NaHCO3相比,Na2CO3不適合作為抗酸藥的理由是_______ 。
【反思評價】
④有小組成員提出,從控制變量和對比實驗的角度看,“實驗探究2”設計不夠嚴謹,你認為不嚴謹之處是_______ 。
參考答案
1.B
【詳解】五谷一般是指稻米、小麥、玉米、大豆和薯類。富含淀粉,淀粉屬于糖類。故選B。
2.A
【詳解】輪船外殼金屬主要為鐵,題目中涉及的金屬活動性為鋅>鐵>鉛>銅>銀,所以應該鑲嵌的金屬為鋅板,故選A。
3.D
【詳解】A、濃硫酸具有吸水性和脫水性,沒有揮發性,故選項說法不正確;
B、同種元素組成的物質不一定是單質,也可能是混合物,如氧氣和臭氧的混合氣體,故項說法不正確;
C、工業上制取氧氣,利用液氮和液氧的沸點不同,沒有新物質生成,屬于物理變化,分子種類沒有發生改變,故選項說法不正確;
D、NaCl是含有金屬元素和非金屬元素的化合物,是由Na+和Cl-構成,故選項說法正確。
故選D。
4.C
【詳解】A、瓶塞應倒放,A錯誤;
B、用天平稱量氫氧化鈉固體質量,氫氧化鈉易潮解,應放在小燒杯中稱量,B錯誤;
C、用量筒量取水的體積操作正確,C正確;
D、不能用量筒配制溶液,量筒只能用與量取液體體積,D錯誤。
故選C。
5.A
【詳解】A、風箱拉動過程中,增加空氣的流通,提供更多的氧氣(助燃物),而非可燃物,故選項說法不合理;
B、拉風箱可以增加氧氣的流通,使煤燃燒更充分,從而維持火爐中的溫度在煤的著火點之上,故選項說法合理;
C、煤不完全燃燒生成一氧化碳,一氧化碳燃燒產生藍色火焰,因此火爐中的藍色火焰是一氧化碳燃燒產生的,故選項說法合理;
D、生鐵和鋼都是鐵的合金,生鐵中的含碳量在2%~4.3%之間,鋼的含碳量在0.03~2%之間,所以,生鐵和鋼的本質區別是含碳量不同,“鍛鐵”的目的是利用碳與氧氣反應生成二氧化碳,降低生鐵中的含碳量,故選項說法合理。
故選A。
6.D 7.C
【解析】
6.A、氯化鈉可用作食品防腐劑,是因為它能使細菌等微生物脫水死亡,而不是因為它是白色固體,錯誤;
B、氫氧化鈉可用作干燥劑,是因為它具有吸水性,而不是因為強堿性,錯誤;
C、碳酸氫鈉用于治療胃酸過多,是因為它能與胃酸(主要成分是鹽酸)反應,而不是因為受熱易分解,錯誤;
D、碳酸鈉溶液呈堿性,可促進油污的水解從而去除油污,正確。
故選D。
7.A、海水曬鹽是通過蒸發水分使氯化鈉結晶析出,沒有新物質生成,主要發生物理變化,不是化學變化,錯誤;
B、電解氯化鈉溶液時,是電能轉化為化學能,而不是化學能轉化為電能,錯誤;
C、氯化銨中含有氮元素,可作氮肥,正確;
D、碳酸鈉固體受熱不易分解,碳酸氫鈉固體受熱易分解,錯誤。
故選C。
8.D
【分析】由反應的微觀示意圖可知,二氧化碳和氫氣在一定條件下生成甲烷和水,反應的化學方程式為CO2+4H2CH4+2H2O。
【詳解】A、由微粒的構成可知,反應前后,分子種類發生改變,故選項說法正確;
B、由反應的化學方程式可知,二氧化碳在反應中失去了氧,發生了還原發應,是氧化劑,故選項說法正確;
C、由反應的化學方程式可知,參加反應的二氧化碳、氫氣的分子個數比為,故選項說法正確;
D、反應物二氧化碳中氧元素的化合價為-2價,碳元素化合價為+4價,氫氣為單質,氫元素的化合價為0;生成物甲烷中氫元素的化合價為+1價,碳元素的化合價為-4價,水中氫元素的化合價為+1,氧元素的化合價為-2價,因此碳元素、氫元素的化合價在化學反應前后發生了改變,故選項說法不正確。
故選D。
9.C
【詳解】A、碳酸鈣在高溫條件下分解生成氧化鈣和二氧化碳,除去了原物質碳酸鈣,不符合除雜原則,實驗方案不可行,不符合題意;
B、緩緩通過足量的灼熱的氧化銅,氮氣、氧氣均與氧化銅不反應,不能除去雜質氧氣,實驗方案不可行,不符合題意;
C、通過足量的碳酸氫鈉溶液,碳酸氫鈉與氯化氫反應生成氯化鈉、二氧化碳和水,能除去雜質氯化氫,再通過濃硫酸,濃硫酸具有吸水性且不與二氧化碳反應,可除去二氧化碳中混有的水蒸氣,最終得到純凈的CO2氣體,實驗方案可行,符合題意;
D、除去Na2SO4溶液中的MgSO4,應加入適量的氫氧化鈉溶液,硫酸鎂與氫氧化鈉反應生成氫氧化鎂沉淀和硫酸鈉,充分反應后過濾除去氫氧化鎂,既除去了雜質硫酸鎂且不會引入新雜質,故該實驗方案不可行,不符合題意。
故選:C。
10.B
【詳解】A、對比實驗A(25℃)和實驗B(40℃),當其他條件都相同,相同時間內,實驗B中某有機物污染濃度比實驗A中下降得更快,而實驗B比實驗A溫度高,可說明升高溫度可以加快有機污染物降解的速率,故選項說法錯誤;
B、實驗E與A對比,其它條件均相同,只有pH不同,實驗E中pH為10>7,顯堿性,某有機物污染濃度不變,即有機物沒有降解,則推測FeSO4在堿性條件下可能失效,故選項說法正確;
C、由曲線 A 和 C 可知,當過氧化氫溶液濃度增大時,污染物降解速率加快;但比較曲線 C 和 D 會發現,D 中硫酸亞鐵溶液的量增加(D 中為 4.5mL,C 中為 3.5mL),雖然過氧化氫溶液濃度減小了,但是降解速率卻比 C 快,說明過氧化氫濃度越大,污染物降解速率不一定越快,還與硫酸亞鐵溶液的量、pH、溫度等其他因素有關,故選項說法錯誤;
D、本實驗中除溫度、pH、過氧化氫溶液濃度外,還研究了硫酸亞鐵溶液的濃度對降解有機污染物速率的影響;實驗A為對照組,實驗A和實驗B對比是探究溫度對降解速率的影響,實驗A和實驗C對比是探究過氧化氫溶液濃度對降解速率的影響;實驗A和實驗E對比是探究pH對降解速率的影響,則實驗A和實驗D對比是探究硫酸亞鐵溶液濃度對降解速率的影響,根據表格數據分析,所取溶液的總體積均為15mL,根據實驗控制變量原則,X=15mL-1.5mL-4.5mL=9mL,故選項說法錯誤;
故選B。
11.(1)延展性(2)強(3)疏松有害銹(4)D
【詳解】
(1)銅可制成銅絲是因為其具有良好的延展性;
(2)該反應是指鐵與硫酸銅反應生成銅和硫酸亞鐵,反應的化學方程式為CuSO4+Fe=Cu+FeSO4,該技術是利用了鐵的金屬活動性比銅的強;
(3)觀察圖示可知,CuCl2 3Cu(OH)2是疏松結構。因為疏松結構不能阻止銹蝕產物進一步深入青銅器內部,所以屬于有害銹;
(4)廢銅制品屬于可回收垃圾,可回收垃圾是指適宜回收循環使用和資源利用的廢物;故答案為:D。
12.(1)900
(2)來源豐富、產物無污染等
(3)2:1 同等條件下,H2的溶解度小于O2(產生了O3也對)
(4)該方法制取H2的純度低于電解水制取H2的純度
【詳解】
(1)溶液可配制0.9%生理鹽水質量,需向其中加入水,體積=900mL,故填:900。
(2)H2作為能源的優點是來源豐富、產物無污染,故填:來源豐富、產物無污染等。
(3)電解水時,正氧負氫,氫二氧一,理論上相同條件下產生H2和O2的體積比是2:1,經準確測量,這兩氣體的體積之比略大于理論值,其可能的原因是同等條件下,H2的溶解度小于O2,故填:2:1;同等條件下,H2的溶解度小于O2。
(4)工業上以CH4為原料制取H2,氫氣中含有雜質氣體一氧化碳和二氧化碳,故填:該方法制取H2的純度低于電解水制取H2的純度。
13.(1)除去剩余的氫氧化鈉和碳酸鈉(2)CaCO3、BaCO3玻璃棒
(3)CaCl2 + Na2CO3== CaCO3↓+2NaCl(4)設至少需要含氫氧化鈉質量分數為32%的氫氧化鈉溶液的質量為x,
x=50t,
答:至少需要含氫氧化鈉質量分數為32%的氫氧化鈉溶液的質量為50噸。
【詳解】
(1)加入過量的氯化鋇溶液時,氯化鋇和硫酸鈉反應生成硫酸鋇沉淀和氯化鈉,加入過量的氫氧化鈉溶液時,氫氧化鈉和氯化鎂反應生成氫氧化鎂沉淀和氯化鈉,加入過量的碳酸鈉溶液時,碳酸鈉和氯化鈣反應生成碳酸鈣沉淀和氯化鈉,和過量的氯化鋇反應生成碳酸鋇沉淀和氯化鈉,加入適量稀鹽酸時,稀鹽酸和過量的氫氧化鈉反應生成氯化鈉和水,和過量的碳酸鈉反應生成氯化鈉、水和二氧化碳。由上述分析可知,加入適量鹽酸的目的是:除去剩余的氫氧化鈉和碳酸鈉;
(2)由上述分析可知,固體甲的成分有BaSO4、Mg(OH)2、CaCO3、BaCO3;操作I是將固體和液體分離的過程,名稱為過濾,需要的玻璃儀器為漏斗、燒杯、玻璃棒;
(3)(4)見答案。
14.(1)Zn+H2SO4==ZnSO4+H2↑ 置換反應(2)B 分液漏斗
(3)水稻秸稈產氫量高、能量轉化率高、木質素含量低小麥秸稈中木質素含量高,將纖維素緊密包圍著,阻礙纖維素與酶之間的接觸,抑制了小麥秸稈的水解
(4)
【詳解】
(1)鋅與稀硫酸發生置換反應,生成硫酸鋅和氫氣,化學方程式為Zn+H2SO4==ZnSO4+H2↑。
(2)實驗室用鋅粒和稀硫酸反應制取氫氣,屬于固液不加熱型反應,發生裝置選 D;氫氣難溶于水,可用排水法收集,可用 A、C 組成收集裝置,使用 E 連接發生裝置與收集裝置,不需要選用的儀器是 B;
儀器M是分液漏斗,可用于控制液體滴加速度。
(3)從表格數據可知,水稻秸稈產氫量446mL大于小麥秸稈的292mL ,能量轉化率6.1%大于小麥秸稈的5.2%,水稻秸稈的木質素含量17.3%低于小麥秸稈木質素含量22.1%;
小麥秸稈暗發酵產氫量低的原因是:小麥秸稈中木質素含量高,將纖維素緊密包圍著,阻礙纖維素與酶之間的接觸,抑制了小麥秸稈的水解。
(4)根據題目所給信息,甲酸在氫化酶催化下分解生成二氧化碳和氫氣,化學方程式為。
16.(1)36
(2)室溫下,碳酸氫鈉的溶解度比氯化銨、氯化鈉小很多
(3)60℃后碳酸氫鈉易分解
(4)氮
(5)
(6)強由圖 2 可知,與相比,反應時造成胃液pH遠大于5;在pH>5的持續時間過長,會導致胃部不適實驗沒有模擬人體的溫度
【詳解】
(1)由溶解度曲線可知,20℃時,NaCl的溶解度是36g,即20℃時,100g水中最多能溶解36g NaCl形成飽和溶液,所以至少要加入36g NaCl。
(2)從溶解度曲線看,室溫下NaHCO3溶解度比NH4Cl、NaCl小很多,反應生成的NaHCO3超出室溫下其在溶液中的溶解能力,就會結晶析出。
(3)碳酸氫鈉受熱易分解,溫度較高時(60℃后)發生分解反應,就無法準確測定其溶解度,所以無數據。
(4)NH4Cl中含有氮元素,在農業生產中可作氮肥。
(5)純堿(Na2CO3)和熟石灰反應會生成碳酸鈣沉淀和氫氧化鈉,化學方程式為。
(6)①碳酸鈉和鹽酸反應生成氯化鈉、水和二氧化碳,化學方程式為。
②pH越大,堿性越強,Na2CO3溶液pH為11,NaHCO3溶液pH為8,所以Na2CO3溶液堿性比NaHCO3溶液強。
③由圖 2 可知,Na2CO3與鹽酸反應后溶液pH超過5,不符合抗酸藥使胃液pH保持在3~5之間的標準,且Na2CO3在pH>5的持續時間過長,易導致胃痛等不適癥狀。
④“實驗探究2”設計不夠嚴謹,因為該實驗在室溫下進行,沒有模擬人體的溫度。
展開更多......
收起↑
 資源預覽
資源預覽