資源簡介
資源簡介
江蘇省南京一中2024-2025學年高一下學期期中化學試卷
一、單項選擇題:(本題共13小題,每小題3分,共39分。每題只有一個選項符合題意。)
1. 下列措施中能有效促進“碳中和”是
A.CO2合成淀粉 B.火力發電 C.燃煤脫硫 D.可燃冰開采
A. A B. B C. C D. D
2. 反應8NH3+3Cl=6NHCl+N2可用于氯氣管道的檢漏。下列表示相關微粒的化學用語正確的是
A. 中子數為9的氮原子: B. NH4Cl分子的電子式:
C. Cl2分子的結構式:Cl—Cl D. Cl-的結構示意圖:
3. 在指定條件下,下列選項所示的物質間轉化能實現的是
A. NO(g)HNO3(aq) B. 稀硝酸NO2
C. NO2(g)HNO3(aq) D. (aq) (aq)
4. 室溫下,下列各組離子在指定溶液中能大量共存的是
A. 溶液:、、、
B. 溶液:、、、
C. 溶液:、、、
D. 溶液:、、、
5. 下列有關物質的性質與用途具有對應關系的是
A. NO2顯紅棕色,可用于火箭燃料中的氧化劑
B. Na2SO3具有還原性,可用于處理自來水中殘留的Cl2
C. SiO2硬度大,可用于制造光導纖維
D. NaHCO3受熱易分解,可用于治療胃酸過多
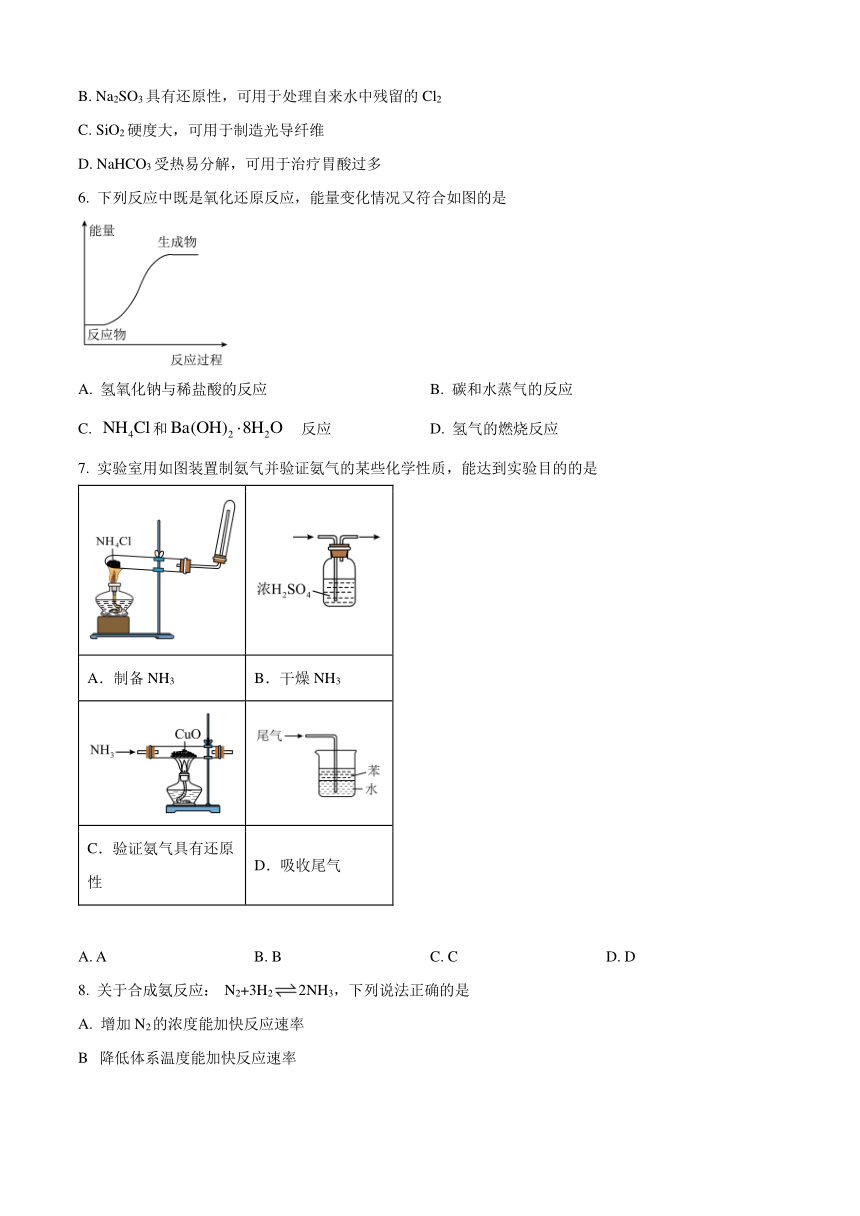
6. 下列反應中既是氧化還原反應,能量變化情況又符合如圖的是
A. 氫氧化鈉與稀鹽酸的反應 B. 碳和水蒸氣的反應
C. 和反應 D. 氫氣的燃燒反應
7. 實驗室用如圖裝置制氨氣并驗證氨氣的某些化學性質,能達到實驗目的的是
A.制備NH3 B.干燥NH3
C.驗證氨氣具有還原性 D.吸收尾氣
A. A B. B C. C D. D
8. 關于合成氨反應: N2+3H22NH3,下列說法正確的是
A. 增加N2的濃度能加快反應速率
B 降低體系溫度能加快反應速率
C. 使用催化劑不影響反應速率
D. 體系中c(N2):c(H2):c(NH3)= 1:3:2,說明反應達到平衡狀態
9. 某密閉容器中,發生反應4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0,下列說法正確的是
A 反應達平衡后
B. 0.4molNH3(g)與足量的O2(g)反應后,可得0.6molH2O(g)
C. 正反應的活化能大于逆反應的活化能
D. 該反應的平衡常數表達式為
10. 中國所究人員研制出一種新型復合光催化劑,利用太陽光在催化劑表面實現高效分解水,其主要過程如圖所示。
已知:幾種物質中化學鍵的鍵能如表所示。
化學鍵 H - O鍵 O= O鍵 H-H鍵 O-O鍵
鍵能/(kJ·mol-1) 463 496 436 138
若反應過程中分解了2molH2O ,則下列說法不正確的是
A. 總反應為2H2O2H2↑+O2↑ B. 過程Ⅲ屬于放熱反應
C. 總反應是吸熱反應 D. 有2mol水參與過程I吸收了926kJ能量
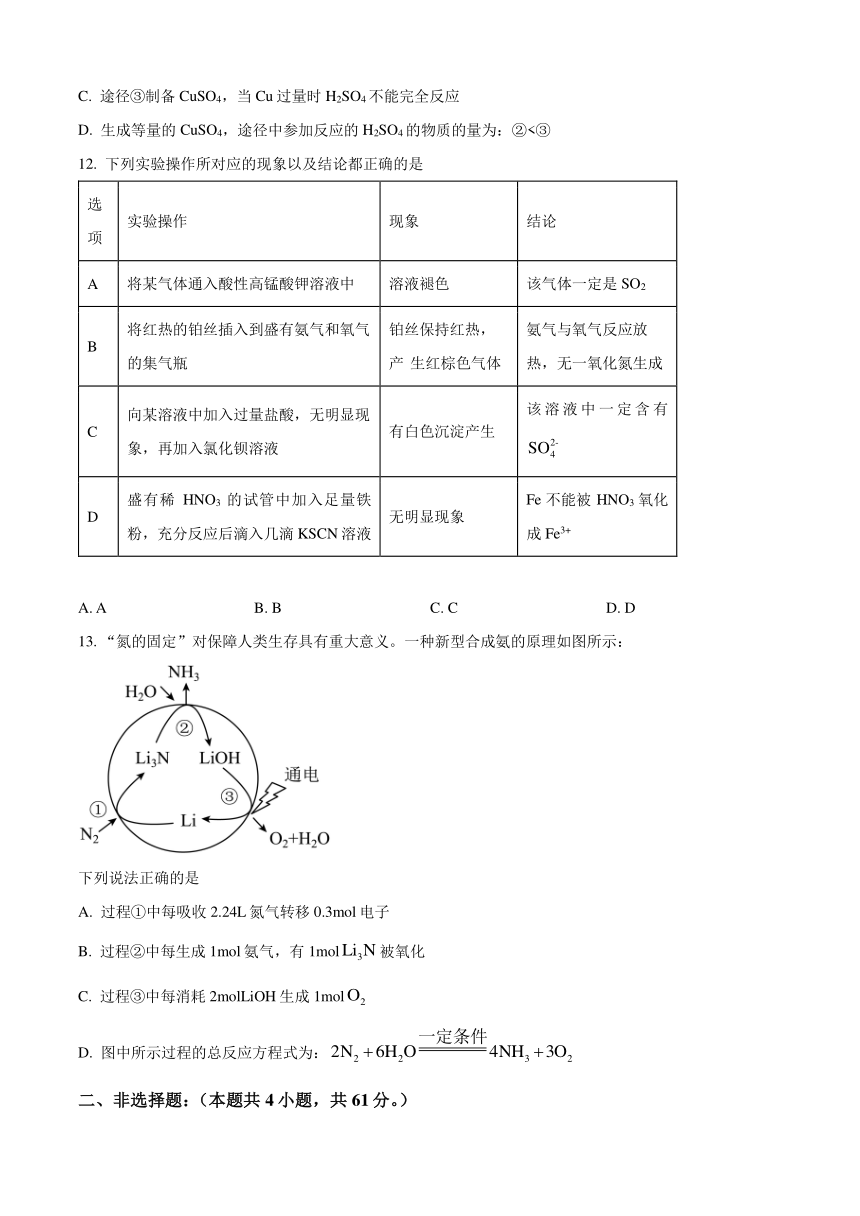
11. CuSO4是一種重要的化工原料,制備途徑如題圖所示,下列說法錯誤的是
A. 途徑②制備0. 1mol CuSO4,被還原的硫酸的物質的量為0.1mol
B 三種途徑中途徑②更體現綠色化學思想
C. 途徑③制備CuSO4,當Cu過量時H2SO4不能完全反應
D. 生成等量的CuSO4,途徑中參加反應的H2SO4的物質的量為:②<③
12. 下列實驗操作所對應的現象以及結論都正確的是
選項 實驗操作 現象 結論
A 將某氣體通入酸性高錳酸鉀溶液中 溶液褪色 該氣體一定是SO2
B 將紅熱的鉑絲插入到盛有氨氣和氧氣的集氣瓶 鉑絲保持紅熱,產 生紅棕色氣體 氨氣與氧氣反應放熱,無一氧化氮生成
C 向某溶液中加入過量鹽酸,無明顯現 象,再加入氯化鋇溶液 有白色沉淀產生 該溶液中一定含有
D 盛有稀HNO3的試管中加入足量鐵粉,充分反應后滴入幾滴KSCN溶液 無明顯現象 Fe不能被HNO3氧化成Fe3+
A. A B. B C. C D. D
13. “氮的固定”對保障人類生存具有重大意義。一種新型合成氨的原理如圖所示:
下列說法正確的是
A. 過程①中每吸收2.24L氮氣轉移0.3mol電子
B. 過程②中每生成1mol氨氣,有1mol被氧化
C. 過程③中每消耗2molLiOH生成1mol
D. 圖中所示過程的總反應方程式為:
二、非選擇題:(本題共4小題,共61分。)
14. 目前工業上有一種方法是用CO2來生產燃料甲醇。一定條件下發生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如圖表示該反應過程中能量(單位為kJ mol-1 )的變化:
(1)該反應的ΔH________0(填“>”“=”或“<”)。
(2)為探究反應原理,現進行如下實驗:在體積為 2L 的密閉容器中,充入4molCO2和12molH2,一定條件 下發生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,經測得CO2(g) 和CH3OH(g) 的濃度隨時間變化如圖所示。
①計算3min內用H2表示的該反應的反應速率v(H2)= _________;3min時,正反應速率________逆反應速率(填“>”“=”或“<”)。
②10min反應達平衡,CO2的轉化率為_________;該反應的平衡常數K=__________。
③下列措施中能加快反應速率的是_________(填字母)。
A.升高溫度 B.保持壓強不變,充入He使容積增大
C.保持體積不變,充入He使壓強增大 D.保持體積不變,充入一定量的CO2
④能說明該反應已達到化學平衡狀態的是__________。
A.容器中混合氣體的密度不再改變 B.c(H2)=3c(CO2)
C.v正(H2)=3v逆(H2O) D.容器內的壓強保持不變
15. 按下列要求填空
(1)S8分子可形成單斜硫和斜方硫,轉化過程如下:S(s,單斜)S(s,斜方) ΔH =-0.398kJ/mol,則S(單斜)、S(斜方)相比,較穩定的是___________[填“S(s,單斜)”或“S(s,斜方)”]。
(2)已知含2.000gNaOH的稀溶液與稀硫酸完全中和,放出2865J的熱量。寫出表示中和熱的熱化學方程式:___________。
(3)已知 23gC2H5OH(l)在O2中完全燃燒生成CO2和液態水,放出akJ的熱量。寫出C2H5OH燃燒熱的熱化學方程式:___________。
(4)已知:2Cu(s)+O2(g)=Cu2O(s) ΔH=-169kJ/mol;C(s)+O2(g)=CO(g) ΔH=-110.5kJ /mol;2Cu(s)+O2(g)=2CuO(s) ΔH =-314kJ/mol。
則工業上用炭粉在高溫條件下還原CuO 制取 Cu2O和CO的熱化學方程式為___________。
(5)已知1g氫氣完全燃燒生成水蒸氣時放出熱量122 kJ。且氧氣中1 mol O=O鍵完全斷裂時吸收熱量496 kJ,水蒸氣中1molH-O鍵形成時放出熱量463 kJ,則氫氣中1 mol H-H鍵斷裂時吸收熱量為___________。
16. 以硫鐵礦(主要成分為)為原料,氨水為沉淀劑制備硫酸亞鐵晶體的實驗流程如下:
已知:硫鐵礦焙燒后的燒渣主要成分為,還含有少量雜質。
(1)實驗室進行“焙燒”操作時,盛裝硫鐵礦的實驗儀器名稱為_______。“酸浸”時為了提高浸取速率,可以采取的措施是_______(任寫一種)。
(2)向“濾液1”中加入時需要控制反應溫度,原因是__________。若用代替,其離子方程式為__________。
(3)“混合液”中加入氨水調節,可使沉淀而不沉淀,“濾液2”中主要成分為_________(填化學式)。
(4)檢驗“還原”時是否完全轉化的實驗操作是__________。
(5)下列說法正確的是________(填標號)。
a.可用于缺鐵性貧血的治療
b.溶液經蒸發結晶可制得
c.溶液中加入少量鐵粉可防止其變質
d.隔絕空氣高溫分解,產物只有和
(6)在氛圍中,的脫水熱分解過程如圖所示:
根據實驗結果可知________。
17. 氮的氧化物(NO、NO2等)是主要的大氣污染物,必須脫除才能排放。
(1)臭氧脫硝法:O3氧化NO結合水洗,可產生HNO3,該反應的化學方程式為___________。
(2)氨氣催化吸收法處理尾氣法:已知 7mol氨氣恰好能將含NO和NO2共6mol 的混合氣體完全轉化為N2,則混合氣體中NO和NO2的物質的量之比___________。
(3)研究不同溫度下經酸化處理的Ca(ClO)2溶液對NO脫除率的影響,結果如下圖所示。在 60~80℃時,NO脫除率下降的原因除了次氯酸鹽水解生成的HClO受熱分解,溶液中HClO的濃度減小,氧化NO能力下降外還有___________。
(4)同時凈化廢氣中二氧化硫和氮的氧化物的方法,將其轉化為硫酸和硝酸,工藝流程如圖所示。 各室中發生的反應如下:
氧化室:NO2+SO2+H2O=H2SO4+NO
清除室:NO+NO2=N2O3、N2O3+2H2SO4=2NOHSO4(固體)+H2O 分解室: 4NOHSO4(固體)+O2+2H2O=4H2SO4 + 4NO2
①物質X和Y分別為___________、___________(填化學式)。
②寫出SO2、O2與H2O反應生成H2SO4的化學方程式:___________。
(5)Fe-Ag金屬復合材料可將酸性水體中的轉化為和N2,其反應歷程如圖所示(吸附在金屬復合材料表面的物種用*標注)。圖中的去除機理可描述為:___________。
江蘇省南京一中2024-2025學年高一下學期期中化學試卷
一、單項選擇題:(本題共13小題,每小題3分,共39分。每題只有一個選項符合題意。)
【1題答案】
【答案】A
【2題答案】
【答案】C
【3題答案】
【答案】C
【4題答案】
【答案】B
【5題答案】
【答案】B
【6題答案】
【答案】B
【7題答案】
【答案】C
【8題答案】
【答案】A
【9題答案】
【答案】D
【10題答案】
【答案】B
【11題答案】
【答案】A
【12題答案】
【答案】C
【13題答案】
【答案】D
二、非選擇題:(本題共4小題,共61分。)
【14題答案】
【答案】(1)< (2) ①. ②. > ③. 75% ④. ⑤. AD ⑥. CD
【15題答案】
【答案】(1)S(s,斜方)
(2)H+(aq)+OH-(aq)=H2O(l) ΔH= 57.3 kJ mol 1
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-2akJ/mol
(4)2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34.5 kJ mol 1
(5)434 kJ
【16題答案】
【答案】(1) ①. 坩堝 ②. 將硫鐵礦粉碎、適當增大硫酸的濃度、適當升高酸浸溫度等
(2) ①. 溫度低反應速率慢,溫度過高則H2O2受熱分解 ②.
(3)Al2(SO4)3、(NH4)2SO4
(4)取少量溶液于試管中,滴入KSCN溶液,如果出現血紅色,說明未完全轉化,若未出現血紅色,說明完全轉化 (5)ac (6)4
【17題答案】
【答案】(1)
(2)1:3 (3)溫度升高,NO溶解度降低,氧化NO的能力下降
(4) ①. NO2 ②. H2SO4 ③. 2SO2+O2+2H2O=2H2SO4
(5)Fe失去電子生成Fe2+,H+在Fe表面得電子生成氫原子并吸附在金屬Ag的表面;氫原子失去電子給吸附在Ag表面的和;得電子生成,得電子生成或N2
展開更多......
收起↑
 資源預覽
資源預覽